Elektrolytické bunky
- 3546
- 589
- Denis Škriniar
 Elektrolytické bunky sú elektrochemické zariadenie na zvýšenie ne -spontánnych oxidových reakcií prostredníctvom elektriny
Elektrolytické bunky sú elektrochemické zariadenie na zvýšenie ne -spontánnych oxidových reakcií prostredníctvom elektriny Čo sú elektrolytické bunky?
Ten elektrolytické bunky Sú to zariadenia používané na zvýšenie chemických reakcií net -konfentánneho redukcie pomocou elektrickej energie. Inými slovami, sú to bunky, v ktorých sa vykonáva proces elektrolýzy, a teda jeho názov.
Je to konkrétny typ elektrochemických buniek. To znamená, že ide o zariadenia, v ktorých druh, ktorý oxiduje a ten, ktorý je znížený.
Z tohto dôvodu sa výmena elektrónov medzi oxidačnými a redukčnými druhmi nevyskytuje priamo, ale prostredníctvom vonkajšieho vodiča.
V prípade, že k redoxnej reakcii dôjde spontánne, to znamená, bez pomoci externého zdroja energie, hovoríme o galvanických bunkách.
Príkladom je auto batéria. Na druhej strane, ak reakcia vyžaduje vonkajší zdroj energie, je to elektrolytická bunka.
Prevádzka elektrolytických buniek
Každá elektrolytická bunka je tvorená niektorými základnými prvkami, ktoré sú:
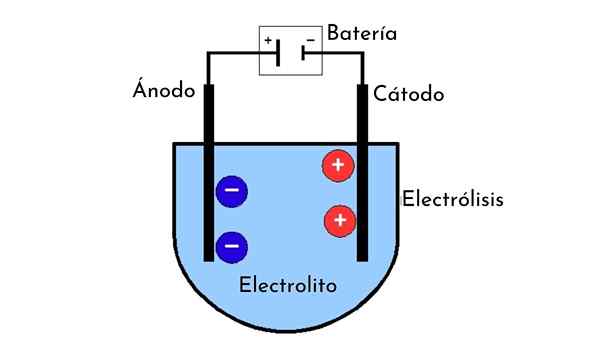
- Dve elektródy nazývané anóda a katóda.
- Roztok látky, ktorú máme v úmysle podrobiť elektrolýze alebo, ak to nie je rovnaká látka v kvapalnom stave (napríklad roztavená soľ).
- Elektrické vodiče.
- Elektrický zdroj energie.
Proces sa vykonáva na reakcie, ktoré za normálnych podmienok nie sú spontánne. To znamená, že ide o redukciu hrdze, ktorého bunkový potenciál, vzhľadom na koncentrácie druhu a podmienky teploty a tlaku, je negatívny.
To znamená, že elektróny nemajú tendenciu ísť od druhu, ktorý chceme oxidovať, na ktoré sa chceme znížiť, ale skôr v opačnom smere. Použitím vonkajšieho napätia opačného znaku môžeme investovať príznaky bunkového potenciálu, čo núti reakciu nastať.
Môže vám slúžiť: rozpustné materiályRovnako ako každá redoxná reakcia, elektrolýza sa vyskytuje vo forme dvoch semi -reakcií, ktoré sa vyskytujú osobitne v dvoch elektródach. Nazývajú sa katóda a anóda.
Katóda
Katóda je elektróda pripojená k negatívnemu pólu zdroja energie a tam sa vyskytuje semifinágrovanie redukcie. Je to tiež elektróda, na ktorú sú pozitívne ióny nasmerované počas elektrolýzy. V skutočnosti odtiaľ pochádza názov katiónov.
Pri reprezentácii procesu elektrolýzy vo forme bunkového diagramu je redukčné semifinále, ktoré sa vyskytuje v katóde.
Anóda
Anóda je elektróda proti katóde. To znamená, že je to elektróda pripojená k pozitívnej sile zdroja energie a v ktorom sa vyskytuje oxidačné polosvetlenie. Je to tiež miesto, na ktoré sú smerované ióny s negatívnym zaťažením (anióny) a sú vždy zastúpené na ľavej strane bunkového diagramu.
Prietok elektrónov v elektrolytickej bunke
Keď sú elektródy pripojené k opačným pólom zdroja energie, ktorý má dostatočne potenciál, obvod sa uzavrie a generuje sa elektrický prúd. Tento prúd začína v anóde, kde redukčný druh oxiduje a stráca elektróny.
Tieto elektróny preteká elektrickým vodičom, poháňaný potenciálnym rozdielom až do dosiahnutia katódy. Akonáhle je na povrchu katódy, elektróny prechádzajú na oxidačné druhy, redukujú ho a dokončia redoxnú reakciu.
Aby prietok elektriny mohol pokračovať, ióny v roztoku alebo roztavená soľ sa pohybujú z jednej elektródy na druhú. Katióny prúdi do katódy a anióny smerom k anóde.
Môže vám slúžiť: Chemické reakcie každodenného životaAj keď sa zdá, že ide o dva prúdy v opačných smeroch, v skutočnosti obidva prúdy idú rovnakým smerom. Je to preto, že nosiče zaťaženia, ktoré sa pohybujú v opačných smeroch, majú tiež opačné zaťaženie.
Typy elektrolytických buniek
Bunky elektrolytu vodného roztoku
Toto sú najbežnejšie bunky. Jednoducho pozostávajú z dvoch elektród niektorých inertných kovov ponorených vo vodnom roztoku soli, ktoré chceme podrobiť elektrolýze.
Slúžia iba na zníženie druhov, ktoré majú pozitívnejší redukčný potenciál ako vodík, za predpokladu, že pH je neutrálne.
Na druhej strane slúžia iba na oxidáciu druhov, ktoré majú oxidačný potenciál väčší ako voda, s výnimkou prepísania kyslíka.
Elektrolytické bunky roztavených soli
V prípadoch, keď chceme druhy, ktoré chceme. Vyžaduje si to špeciálnu bunku, napríklad bunku Downs's.
Elektrolytické bunkové aplikácie
Elektrolytické bunky majú v priemysle veľký význam. Niektoré z najdôležitejších aplikácií sú:
Ukladanie energie
Elektrolýza umožňuje premeniť energiu elektrického potenciálu na potenciálnu chemickú energiu. Znížené a oxidované druhy počas procesu elektrolýzy sa stávajú novými druhmi schopnými spontánne reagovať a znova uvoľňujú energiu invertovanú.
Výroba elementárnych halogénov
Halogény majú veľký priemyselný význam. Nie sú však v podstate zásadne, pretože sú veľmi reaktívnymi oxidačnými látkami. Z tohto dôvodu sa veľa halogénov môže vyskytnúť iba elektrolýzou.
Môže vám slúžiť: dispergingová fázaVýroba čistého kovu
To isté, čo možno povedať o halogénoch, možno povedať aj o najreaktívnejších kovoch periodickej tabuľky. Prvky, ako sú alkalické a medené kovy, sa dajú získať iba elektrolýzou roztavených solí a vodných roztokov.
Príklady elektrolytických buniek v každodennom živote
Elektrolýza fluoridu sodného
Fluorid sodný s roztaveným sodným sa používa priemyselne na výrobu elementárneho sodíka a fluóru. Fluór sa potom môže použiť na získanie ďalších menej reaktívnych halogénov.
Elektrolýza meďnatého
V priemyselnej výrobe medi sa to získava elektrolýzou vodných roztokov jej solí. Okrem toho sa meď čistí aj elektrolýzou, oxidáciou a rozpúšťaním z elektródy a jej ukladaním do druhého.
Elektrolýza vody
Elektrolýza vodného roztoku kyseliny sírovej rozkladá kyslík a vodíkovú vodu a je jedným z najjednoduchších spôsobov, ako získať tento posledný prvok v čistej forme.
Odkazy
- Korint - všeobecná chémia (s. F.). Elektrolytické bunky. Prevzatý z Korintu.Pucp.Edu.pešo.
- Ekurovaný (s. F.). Elektrolytická bunka. Prevzatý z Eurcer.Cu.
- Luis Manuel (2014). Typy elektrochemických buniek. Prevzaté z Prezi.com.
- Zastavenie p., Jo. (2021). Čo je elektrolytická bunka? Prevzatý z Yubrainu.com.

