Rovnocenná hmotnosť
- 1187
- 322
- Mgr. Pravoslav Mokroš
Aká je ekvivalentná váha?
On rovnocenná hmotnosť Je to hmotnosť alebo hmotnosť ekvivalentu látky. To znamená, že je to hmotnosť alebo hmotnosť látky, ktorá sa chemicky rovná 1 mólu inej látky toho istého typu, ktorý sa používa ako referenčný obrazec a považuje sa za normálne.
Normálna látka považovaná ako referencia závisí od typu chemickej reakcie a úlohy, ktorú zlúčenina hrá v tejto reakcii. Normálne zlúčeniny vždy reagujú navzájom so stechiometriou 1: 1.
Napríklad, ak hovoríme o reakcii kyseliny/bázy, ekvivalentná hmotnosť kyseliny by bola hmotnosť uvedená zlúčenina ekvivalentná 1 mol normálnej kyseliny, ktorá je taká, ktorá má jeden ionizovateľný protón.
Predtým, ako bolo známe, že hmota bola tvorená atómami a molekulami, už bola stanovená séria zákonov, ktoré určili hmotnostný vzťah (alebo hmotnosť) medzi činidlami a produktmi chemickej reakcie.
Tieto zákony tvorili základy stechiometrických výpočtov počas začiatku chémie ako vedy.
Koncept ekvivalentnej hmotnosti súvisí s týmto počiatočným štádiom vývoja chémie. Ďalej budeme diskutovať o tom, ako sa vypočíta, na čo ide a niektoré bežné príklady vášho výpočtu.
Vzorec a ekvivalentné hmotnostné jednotky
Ekvivalentná hmotnosť sa vypočíta z molekulovej hmotnosti jednej látky pomocou nasledujúceho vzorca:
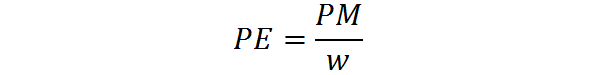
Kde PE je ekvivalentná hmotnosť, PM je molekulová hmotnosť alebo molárna hmotnosť látky a W predstavuje počet ekvivalentov na mol.
Ten vždy pozostáva z celého čísla rovnako alebo viac ako 1. Predstavuje počet molekúl „normálneho“ činidla, ku ktorému je každá molekula látky rovnocenná. Preto závisí od typu príslušného činidla a typu príslušnej chemickej reakcie.
Môže vám slúžiť: dihydroxyacetón: štruktúra, vlastnosti, získanie, použitiaMôže sa tiež vypočítať z cesta, m a počet ekvivalentov:
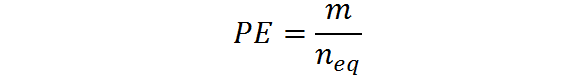
Rovnocenné hmotnostné jednotky
Ako je zrejmé z predchádzajúceho vzorca, ekvivalentná hmotnosť je vyjadrená v hmotnostných jednotkách (zvyčajne gramoch) na počte ekvivalentu. To znamená, že jednotky sú g/eq.
Hodnota W V prvom predchádzajúcom receptúre je exprimovaný v ekvivalentných jednotkách na mol (Eq/mol), zatiaľ čo molárna hmota je exprimovaná v gramoch nad mol (G/mol).
Aká je ekvivalentná váha pre?
Hlavnou užitočnosťou ekvivalentnej hmotnosti je to, že zjednodušuje stechiometrické výpočty. Ekvivalentná hmotnosť látky je rovnocenná s inou látkou toho istého typu a pre rovnaký druh chemickej reakcie. V skutočnosti odtiaľ získa svoje meno.
To nám umožňuje vykonávať stechiometrické výpočty veľmi jednoduchým spôsobom a bez potreby písať a vyvážiť chemické rovnice.
Ako sa počíta ekvivalentná hmotnosť?
Ako sme videli predtým, ekvivalentná hmotnosť sa vypočíta z molekulovej hmotnosti a počtu ekvivalentov na mol alebo w.
Výpočet molekulovej hmotnosti
Molekulová hmotnosť látky je určená pridaním atómovej hmotnosti všetkých atómov, ktoré ju tvoria. Tieto atómové hmotnosti sa nachádzajú v periodickej tabuľke.
Určenie W
Hodnota W Pre látku závisí od typu reakcie, v ktorej je zapojená. To znamená, že to závisí od typu príslušného činidla. Pre každý typ látky existuje iný spôsob určenia W.
Nasledujúca tabuľka ukazuje, ako sa určí W Pre rôzne prípady.
Môže vám slúžiť: chlórnan vápenatý (CA (CLO) 2)| Typ činidla | Hodnota W |
| Kyseliny | Počet ionizovateľných hydrogénov pre každú molekulu kyseliny. |
| Základne | Počet protónov, ktoré môžu zachytiť alebo neutralizovať každú základnú molekulu. |
| Oxidačné činidlá | Počet elektrónov, ktoré zachytávajú každú mol oxidačného činidla v semi -odplatení redukcie. |
| Redukcia agentov | Počet uvoľnených elektrónov každého móla redukčného činidla v oxidačnej semi -rekukcii. |
| Choď von | Celkový počet kladných alebo záporných nábojov, ktoré sa generujú, keď jedna zo soli. |
| Neutrálne látky | 1 |
Je potrebné poznamenať, že ak sa látka môže zúčastniť viac ako jedného typu chemickej reakcie, môže mať viac ako jednu hodnotu W A preto viac ako jedna ekvivalentná hmotnosť.
Dôležitosť a aplikácie rovnocennej hmotnosti
Ekvivalentná hmotnosť sa používa na výpočet počtu ekvivalentov chemikálie. Tento počet ekvivalentov sa vždy rovná počtu ekvivalentov inej látky, s ktorou reaguje.
Používa sa to hlavne v dvoch rôznych oblastiach:
V analytickej chémii
Ekvivalenty sa často používajú na uľahčenie stechiometrických výpočtov v analytickej chémii. To platí najmä v prípade objemovej a gravimetrickej analýzy.
Znalosť objemu stupňa v bode ekvivalencie a koncentrácie titulárneho, ako aj ekvivalentnej hmotnosti oprávneného, ľahko umožňujú vypočítať hmotnosť analytu prítomného vo vzorke.
Pri elektrolýze
V oblasti elektrolýzy predstavuje ekvivalentná hmotnosť hmotnosť jedného kovu alebo inej látky, ktorá sa môže vyskytnúť, keď 96.500 ° C sa zaťaženie elektrolytickou bunkou. To uľahčuje stechiometrické a ekonomické výpočty procesu elektrolýzy.
Môže vám slúžiť: oxid ortuti (HG2O)Príklady výpočtu ekvivalentnej hmotnosti
Vápnik
Atómová hmotnosť vápnika je 40 a tento kov tvorí katióny s Valencia +2, takže jej ekvivalentná hmotnosť je 40/2 = 20 g/eq.
Kyselina sírová (H2SW4)
Molekulová hmotnosť tejto zlúčeniny je 98 a je diprotická kyselina, takže W = 2. Preto ekvivalentná hmotnosť je PE: 98/2 = 49 g/eq.
Hliníkový hydroxid (AL (OH)3)
Hliníkový hydroxid (PM = 78) je amfoterová zlúčenina, ktorá môže pôsobiť ako kyselina a ako báza.
Ak konáte ako základ prepustením svojich troch hydroxidov, potom W = 3, Takže PE: 78/3 = 26 g/eq. Na druhej strane, keď pôsobí ako kyselina, zachytáva molekulu vody a uvoľňuje protón, takže v tomto prípade, W = 1 a PE = 78 g/eq.
Fosfát vápenatého (CA3(PO4)2)
Fosforečnan vápenatý je soľ, ktorá pri disociácii produkuje 3 CA ióny2+ a 2 ióny po43-.
V každom prípade je počet zaťažení rovnakým znakom, aký produkuje každá jednotka fosfátu vápenatého W = 6 a PE = 310/6 = 51,67 g/eq.
Odkazy
- Univerzálna encyklopédia (s. F.). Rovnocenná hmotnosť. Prevzatý z encyklopédie_universal.Es-akademický.com.
- Chémia, anorganická chémia (s. F.). Rovnocenná hmotnosť. Prevzaté z celého fulquimica.com.
- Chémia.Je to (s. F.). Rovnocenný. Prevzaté z chémie.je.
- Spiegato (2021). Aká je ekvivalentná váha? Prevzaté zo Spiegato.com.

