Kovár
- 4021
- 257
- Gabriel Bahna
Aký je kovový charakter?
On Kovový charakter prvkov Periodická tabuľka sa týka všetkých tých premenných, chemických a fyzikálnych, ktoré definujú kovy alebo odlišujú ich od iných prírodných látok. Zvyčajne sú jasné, husté, tvrdé, vysoké tepelné a elektrické, formovateľné a ťažné vodivosti.
Nie všetky kovy však vykazujú takéto charakteristiky; Napríklad v prípade ortuti je to jasne čierna tekutina. Tieto premenné tiež závisia od pozemského tlaku a teplotných podmienok. Napríklad zjavne nemetalický vodík sa môže v extrémnych podmienkach fyzicky správať ako kov.
Tieto podmienky môžu byť: pod priepastným tlakom alebo veľmi chladnými teplotami okolo absolútnej nuly. Na definovanie, či je prvok kovový alebo nie, je potrebné zvážiť skryté vzorce v očiach pozorovateľa: atómové vzory.
Tieto diskriminujú väčšiu presnosť a spoľahlivosť, aké sú kovové prvky, a dokonca aj aký prvok je viac kovový ako iný.
Týmto spôsobom, skutočný kovový charakter zlatej mince spočíva viac na vlastnostiach jej atómov ako tie, ktoré sú určené jeho zlatou hmotou, dokonca aj obaja sú úzko spojené.
Ktorá z mincí je viac kovová: jedna zo zlata, jedna z meďrých alebo platina? Odpoveď je platina a vysvetlenie spočíva v atómoch.
Ako sa mení kovový charakter prvkov v periodickej tabuľke?
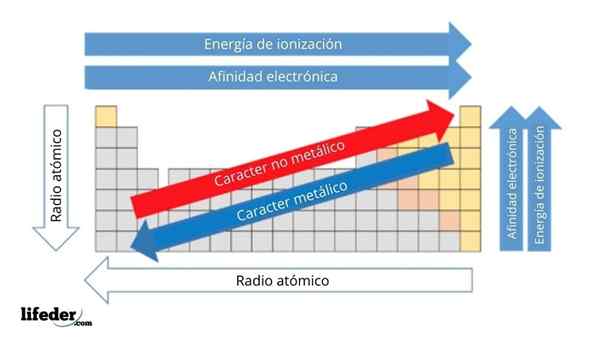
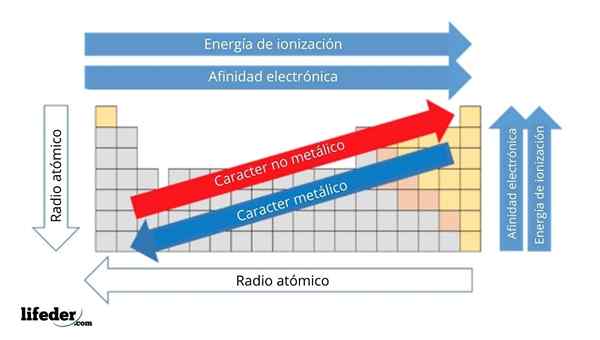
Na hornom obrázku máte periodické vlastnosti prvkov. Riadky zodpovedajú obdobím a stĺpcom skupinám.
Kovový charakter klesá zľava doprava po periodickej tabuľke a zvyšuje sa v opačnom smere. Podobne sa kovový charakter zvyšuje zhora nadol a klesá, keď sa obdobia prechádzajú do skupinových hláv.
Môže vám slúžiť: Základy: Charakteristiky a príkladyTýmto spôsobom majú prvky, ktoré sú blízko smeru, ku ktorému majú body šípky väčší kovový charakter ako tie, ktoré sa nachádzajú v opačnom smere (žlté bloky).
Okrem toho ostatné šípky zodpovedajú iným periodickým vlastnostiam, ktoré definujú, v akom zmysle sa zvyšujú alebo znižujú, pretože prvok je „kovový“. Napríklad prvky žltých blokov, hoci majú nízky kovový charakter, ich elektronická afinita a ionizačná energia sú vysoké.
V prípade atómových rádií, čím väčšie, tým kovovejšie je prvok; Toto je naznačené modrou šípkou.
Vlastnosti kovových prvkov
V periodickej tabuľke sa pozoruje, že kovy majú veľké atómové rádiá, nízke ionizačné energie, nízke elektronické afinity a nízke elektronegativity. Ako si zapamätať všetky tieto vlastnosti?
Bod, na ktorý tok, je reaktivita (elektropozitivita), ktorá definuje kovy, ktoré oxidujú; to znamená, že ľahko strácajú elektróny.
Keď stratia elektróny, kovy tvoria katióny (m+). Preto prvky s najvyššou kovovou tvorbou znakov ľahšie ako tie, ktoré majú nižší kovový charakter.
Príkladom vyššie uvedeného je zvážiť reaktivitu prvkov skupiny 2, alkalinoterróznych kovov. Berylium je menej kovové ako horčík, a to je zase menej kovové ako vápnik.
Takže až do dosiahnutia kovového bario, najreaktívnejšia skupina (po polomere, rádioaktívny prvok).
Ako ovplyvňuje atómový polomer reaktivity kovov?
Keď sa atómový polomer zvyšuje, elektróny vo Valencii sú ďalej od jadra, takže sú zachované s menšou silou v atóme.
Môže vám slúžiť: hydroxid sodný (NaOH): štruktúra, vlastnosti, použitia, syntézaAk sa však obdobie prechádza na pravú stranu periodickej tabuľky, jadro pridáva do tela protóny, ktoré sú teraz pozitívnejšie, čo priťahuje valenčné elektróny silnejšie, čím sa zmenšuje veľkosť atómového polomeru. To má za následok zníženie kovového charakteru.
Veľmi malý atóm a veľmi pozitívne jadro má teda tendenciu získať elektróny namiesto ich straty (nemetalické prvky) a tie, ktoré môžu vyhrať a stratiť elektróny, sa považujú za metaloidy. Niektoré z týchto metaloidov sú bóry, kremík, germanio a arzén.
Na druhej strane, atómový polomer sa zvyšuje aj vtedy, ak existuje nová dostupnosť energie pre iné orbitály, ku ktorým dochádza, keď zostupuje v skupine.
Z tohto dôvodu, keď zostupuje v periodickej tabuľke, rádiá sa stávajú objemnými a jadro sa nestane neschopným zabrániť tomu, aby iné druhy vytrhli elektróny z vonkajšej vrstvy.
V laboratóriu so silným oxidačným činidlom zriedenou kyselinou dusičnou (HNO3)- Kovové reaktivity je možné preštudovať oxidáciu.
Podobne sú formovacie procesy ich halogenidov kovov (napríklad NaCl) tiež demonštračnými experimentmi tejto reaktivity.
Prvok väčšieho kovového charakteru
 Cézium
Cézium Smer modrej šípky v obraze periodickej tabuľky vedie k prvkom Francio a Cesio. Francio je viac kovové ako cézium, ale na rozdiel od toho je Francio umelé a rádioaktívne. Z tohto dôvodu Cesium zaberá miesto prírodného prvku väčšieho kovového charakteru.
Môže vám slúžiť: oxid železaV skutočnosti je jednou z najznámejších (a výbušných) známych reakcií tá, ktorá sa vyskytuje, keď kus (alebo kvapky) cézia príde do styku s vodou.
Vysoká reaktivita cézia, tiež preložená do tvorby oveľa stabilnejších zlúčenín, je zodpovedná za náhle uvoľňovanie energie:
2cs (s) + 2h2O → 2csoh (aq) + h2g)
Chemická rovnica umožňuje vidieť oxidáciu cézia a redukciu vodíka vodíka na plynný vodík.
Prvok dolného kovového charakteru
 3D fluórový model
3D fluórový model V opačnom diagonále, v pravom hornom rohu periodickej tabuľky, fluorid (F2, Superior Image) vedie zoznam nemetalických prvkov. Pretože? Pretože je to prvok v najviac elektronegatívnej povahe a ten s najnižšou ionizačnou energiou.
Inými slovami, reaguje so všetkými prvkami periodickej tabuľky za vzniku iónu f- A nie f+.
Fluór je veľmi nepravdepodobné, že v určitej chemickej reakcii stratí elektróny, celkom v rozpore s kovmi. Z tohto dôvodu je to prvok dolného kovového charakteru.
Odkazy
- Lumen, chémia pre nevýborov. Kovový a nemetový charakter. Zotavené z kurzov.Lumenarning.com
- Chémia. (2018). Elektropostictivita alebo kovový charakter. Zotavené z priradenia chémie.com
- Juan Ramos. Kompletný zoznam kovov a non kovov. Zotavené z ScienceTrends.com
- Anne Marie HelMestine, pH.D. Vlastnosti a trendy kovových znakov. Zotavené z Thoughtco.com

