Fosforečnan horečnatý (MG3 (PO4) 2)
- 4733
- 1525
- Mgr. Pravoslav Mokroš
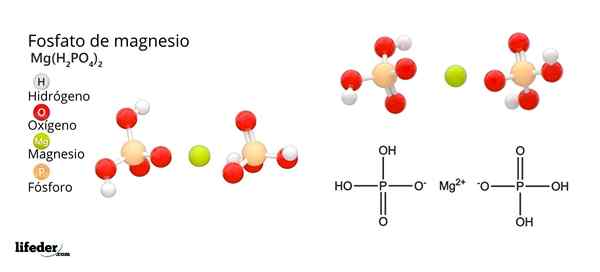
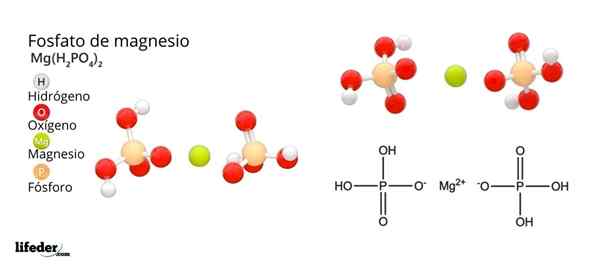 Štruktúra a vzorec fosforečnanu horčíka
Štruktúra a vzorec fosforečnanu horčíka Čo je fosfát horčíka?
On Fosforečnan horečnatého Je to termín, ktorý sa používa na označenie rodiny anorganických zlúčenín tvorených horčíkom, alkalickým kovom a oxoanionom fosfátov. Najjednoduchší fosforečnan horečnatý má chemický vzorec mg3(PO4)2. Vzorec naznačuje, že pre každé dva anióny PO43- Existujú tri mg katióny2+ Interakcia s nimi.
Tieto zlúčeniny možno tiež opísať ako solí horčíka odvodené z kyseliny ortofosfahovej (H3Po4). Inými slovami, horčík je „zhromažďovaný“ medzi fosfátovými aniónmi, bez ohľadu na jeho anorganickú alebo organickú prezentáciu (mgo, mg (nie3)2, Mgcl2, Mg (oh)2, atď.).
Z týchto dôvodov možno nájsť fosfáty horečnatého ako niekoľko minerálov. Niektoré z nich sú: catteite -mg3(PO4)2 · 22h2O-, struvita -(nh4) Mgpo4· 6h2Alebo, ktorého mikrokryštály sú zastúpené v vynikajúcom obraze -Holtedita -MG2(PO4) (Oh) - a bobierrite -mg3(PO4)2· 8h2Ani-.
V prípade bobierritu je jeho kryštalická štruktúra monoklinická, s kryštalickými agregátmi s masívnymi ventilátormi a rozetmi. Fosfáty horečnatý sa však vyznačujú vykazovaním bohatej štrukturálnej chemikálie, čo znamená, že ich ióny prijímajú mnoho kryštalických usporiadaní.
Tvary fosforečnanu horečnatý a neutralita ich zaťaženia
Fosfáty horečnatý odvodzujú z výmeny H protónov3Po4. Keď kyselina ortofosforečná stratí protón, zostáva ako fosfátový dihydrogénový ión2Po4-.
Ako neutralizovať negatívne zaťaženie, aby spôsobil horčíkovú soľ? Áno mg2+ Zodpovedať za dva pozitívne poplatky, potom potrebujete dve h2Po4-. Získa sa teda fosfát horčíka diacido fosfát, mg (h2Po4)2.
Potom, keď kyselina stráca dva protóny, zostáva ión hydrogenfosfátu, HPO42-. Ako teraz neutralizovať tieto dva negatívne náboje? Ako mg2+ Na neutralizáciu potrebujete iba dve negatívne náboje, interakcie s jedným iónom HPO42-. Týmto spôsobom sa získa fosforečnan kyseliny horčíkovej kyseliny: MGHPO4.
Môže vám slúžiť: oxid horečnatý: štruktúra, vlastnosti, nomenklatúra, použitiaNakoniec, keď sa stratia všetky protóny, zostáva fosfátový anión43-. To si vyžaduje tri katióny MG2+ a od iného fosfátu, ktorý sa zostavuje v kryštalickej pevnej látke. Matematická rovnica 2 (-3) + 3 (+2) = 0 pomáha porozumieť týmto stechiometrickým pomerom pre horčík a fosfát.
V dôsledku týchto interakcií sa vytvára kmeňový fosforečnan horečnatý: MG3(PO4)2. Prečo je kmeňové? Pretože je schopný prijať ekvivalent troch H+ Aby znova vytvoril H3Po4:
Po43-(Ac) + 3h+(Ac) h3Po4(Ac)
Fosforečnany horčíka s inými katiónmi
Kompenzácia negatívnych poplatkov je možné dosiahnuť aj účasťou iných pozitívnych druhov.
Napríklad na neutralizáciu PO43-, K ióny+, Nat+, Rb+, NH4+, atď., Môžu tiež prisahať a tvoria zlúčeninu (x) mgpo4. Ak sa x rovná NH4+, Vytvára sa bezvodý struvitný minerál (NH4) Mgpo4.
Poskytnúť. Vďaka tomu je možné syntetizovať početné kryštály fosforečnanu horečnatého (na3Rbmg7(PO4)6, Napríklad).
Štruktúra

Vynikajúci obrázok ilustruje interakcie medzi mg iónmi2+ a po43- ktorá definuje kryštalickú štruktúru. Je to však iba obraz, ktorý demonštruje skôr tetraedrálnu geometriu fosfátov. Potom kryštalická štruktúra znamená fosfátové a horčíkové gule Tetrahedra.
V prípade mg3(PO4)2 bezvodý, ióny prijímajú rhombohedrálnu štruktúru, v ktorej mg2+ je koordinovaný so šiestimi atómami O.
Vyššie uvedené je znázornené na spodnom obrázku s rozmerom, že modré gule sú kobalt, len ich menia za zelené gule horčíka:
Môže vám slúžiť: neoterné zliatiny: štruktúra, vlastnosti, použitia, príklady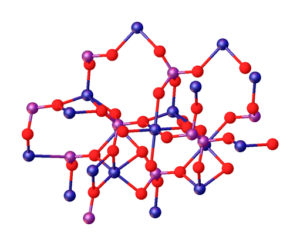
Práve v strede konštrukcie sa môže umiestniť oktaedro vytvorené šiestimi červenými guľami okolo modrej gule.
Tieto kryštalické štruktúry sú tiež schopné prijímať molekuly vody, tvoriace hydraty horčíka fosforečnanu.
Je to preto, že tvoria vodíkové mosty s fosfátovými iónmi (Hoh-O-PO33-). Okrem toho je každý fosfátový ión schopný prijať až štyri vodíkové mosty; to znamená štyri molekuly vody.
Ako mg3(PO4)2 Má dva fosfáty, môže akceptovať osem molekúl vody (čo sa deje s minerálom Bobierrite). Tieto molekuly vody na druhej strane môžu tvoriť vodíkové mosty s ostatnými alebo interagovať s pozitívnymi MG centrami2+.
Vlastnosti
Je to biela tuhá látka, ktorá tvorí kryštalické kostrové platne. Tiež nemá žiadnu vôňu a príchuť.
Je veľmi nerozpustný vo vode, aj keď je horúca, vďaka svojej veľkej kryštalickej sieti; Toto je produkt silných elektrostatických interakcií medzi všestrannými iónmi MG2+ a po43-.
To znamená, že keď sú ióny všestranné a ich iónové rádiá sa nemenia veľkej veľkosti, tuhá látka vykazuje odolnosť voči jej rozpusteniu.
Roztopí sa na 1184 ° C, čo tiež naznačuje silné elektrostatické interakcie. Tieto vlastnosti sa líšia v závislosti od toho, koľko molekúl absorbuje vodu, a či je fosfát v niektorých jeho protonovaných formách (HPO42- alebo h2Po4-).
Použitie/aplikácie
Preháňajúci
Používa sa ako preháňadlo pre stavy zápchy a žalúdočnej kyslosti. Avšak jeho škodlivé vedľajšie účinky - prejavené generovaním hnačky a zvracania - ich použitia obmedzili. Okrem toho pravdepodobne spôsobí poškodenie gastrointestinálneho traktu.
Môže vám slúžiť: molekulárny kyslík: štruktúra, vlastnosti, použitieOprava kostí
V súčasnosti sa skúma použitie fosforečnanu horečnatého pri oprave kostného tkaniva a skúma aplikáciu MG (H2Po4)2 ako cement.
Táto forma fosforečnanu horečnatého spĺňa požiadavky: je biologicky odbúrateľný a histokompatibilný. Okrem toho sa jeho použitie pri regenerácii kostného tkaniva odporúča pre jeho odpor a rýchle nastavenie.
Materiál pre ortopédiá
Použitie amorfného fosforečnanu horečnatého (AMP) sa hodnotí ako biologicky odbúrateľný a neexotermický ortopedický cement. Na generovanie tohto cementu sa mieša prášok AMP s polyvinylalkoholom, aby sa vytvoril tmel.
V živých bytostiach
Hlavnou funkciou fosforečnanu horečnatého je slúžiť ako príspevok MG pre živé bytosti. Tento prvok zasahuje do mnohých enzymatických reakcií, ako je katalyzátor alebo sprostredkovateľ, ktorý je nevyhnutný pre život.
Nedostatok Mg u ľudí je spojený s nasledujúcimi účinkami: zníženie hladín CA, zlyhanie srdca, retencia NA, znížené hladiny K, arytmie, trvalé svalové kontrakcie, zvracanie, nevoľnosť, nízka cirkulujúca hladina paratyreózového hormónu a žalúdka a menštruálnych kŕčov, medzi inými.
Odkazy
- Publikovanie minerálnych údajov. (2001-2005). Bobierrit. Obnovené z príručky.orgán
- Sahar Mousa. (2010). Štúdia o syntéze materiálov fosforečnanu horčíka. Fosfor Research Bulletin Vol. 24, str. 16-21.
- Wikipedia. (2018). Kmeňový fosforečnan horečnatý. Získaný z.Wikipedia.orgán
- Publikácia. (2018). Bezvodý. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda
- Barbie, e., Lin, B., Goel, v.Klimatizovať. A Bhaduri, s. (2016) Hodnotenie amorfného amp-fosforečnanu (AMP) na báze neextermického ortopedického cementu na báze AMP. Biomedicínska rohož. Zväzok 11 (5): 055010.
- Yu a., Yu, ch. A dai, h. (2016). Príprava degrovateľného cementu kosti horčíka. Regeneratívne biomateriály. Zväzok 4 (1): 231

