Diferenciálny elektrón

- 4558
- 362
- MUDr. Miloslav Habšuda
On diferenciálny elektrón o diferenciátor je posledný elektrón umiestnený v sekvencii elektronickej konfigurácie atómu. Ako sa voláš? Na zodpovedanie tejto otázky je potrebné poznať základnú štruktúru atómu: jeho jadro, prázdnotu a elektróny.
Jadro je hustý a kompaktný agregát pozitívnych častíc nazývaných protóny a neutrálne častice nazývané neutróny. Protóny definujú atómové číslo Z a spolu s neutrónmi tvoria atómovú hmotu. Atom však nemôže nosiť iba pozitívne obvinenia; Preto elektrónová obežná dráha okolo jadra na jeho neutralizáciu.
 Základná štruktúra atómu: hlavné subatomické častice
Základná štruktúra atómu: hlavné subatomické častice Pre každý protón, ktorý prispieva do jadra, je do jeho orbitálov začlenený nový elektrón, aby pôsobil proti rastúcemu kladnému náboja. Týmto spôsobom je nový pridaný elektrón, diferenciálny elektrón, úzko súvisí s atómovým číslom Z.
Diferenciálny elektrón sa nachádza v najvzdialenejšej elektronickej vrstve: vrstva Valencia. Preto čím ďalej je jadro, tým väčšia je energia s ním spojená. Táto energia je zodpovedná za jej účasť, ako aj za energiu zvyšku elektrónov vo Valencii, v chemických reakciách charakteristických prvkov.
[TOC]
Kvantové čísla
Rovnako ako zvyšok elektrónov, diferenciálny elektrón je možné identifikovať svojimi štyrmi kvantovými číslami. Ale aké sú kvantové čísla? Sú to „N“, „L“, „M“ a „S“.
Kvantové číslo „N“ označuje veľkosť atómu a energie (K, L, M, N alebo, P, Q). „L“ je sekundárne alebo amemutálne kvantové číslo, ktoré označuje tvar atómových orbitálov a berie hodnoty 0, 1, 2 a 3 pre orbitály „s“, „p“, „d“ a „f „, respektíve.
Môže vám slúžiť: aforovaná banka: Charakteristiky, na čo ide, typy, používa"M" je magnetické kvantové číslo a označuje priestorovú orientáciu orbitálov pod magnetickým poľom. Teda 0 pre orbitálnu „s“; -1, 0, +1, pre orbitálnu „p“; -2, -1, 0, +1, +2, pre orbitálnu „d“; a -3, -2, -1, 0, +1, +2, +3, pre orbitálnu „f“. Nakoniec kvantový počet spin „s“ (+1/2 pre ↑ a -1/2 pre ↓).
Preto diferenciálny elektrón súvisí s predchádzajúcimi kvantovými číslami („N“, „L“, „M“, „S“). Pretože pôsobí proti novému kladnému zaťaženiu generovaným doplnkovým protónom, poskytuje tiež atómové číslo Z prvku.
Ako poznať diferenciálny elektrón?
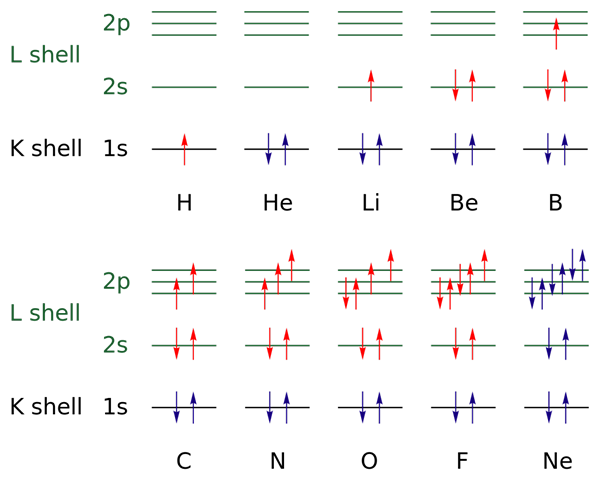
Na hornom obrázku sú pre prvky z vodíka po neónový plyn reprezentované elektronické konfigurácie (H → NE).
V tomto sú elektróny otvorených vrstiev označené farbou červenou farbou, zatiaľ čo vrstvy v uzavretých vrstvách sú označené farbou modrou farbou. Vrstvy odkazujú na kvantové číslo „n“, prvé zo štyroch.
Týmto spôsobom konfigurácia Valencie H (↑ červeného) pridáva ďalší elektrón s opačnou orientáciou, aby sa stal konfiguráciou HE (↓ ↑, obidve modré, pretože teraz je úroveň 1 uzavretá). Tento pridaný elektrón je potom diferenciálny elektrón.
Preto je možné pozorovať, ako diferenciálny elektrón zvyšuje valenčnú vrstvu (červené šípky) z prvkov, čím sa odlišuje od seba navzájom. Elektróny vyplňujú orbitály rešpektujúce pravidlo umývadla a princíp vylúčenia Paulingu (dokonale pozorované od B do NE).
A čo kvantové čísla? Tieto definujú každú šípku - to znamená každý elektrón - a jeho hodnoty môžu byť potvrdené elektronickou konfiguráciou, aby zistili, či sú alebo nie sú hodnoty diferenciálneho elektrónu alebo nie.
Môže vám slúžiť: aké sú negatívne účinky, ktoré máme s rozpustnosťou vody?Príklady diferenciálnych elektrónov v niekoľkých prvkoch
Chlór
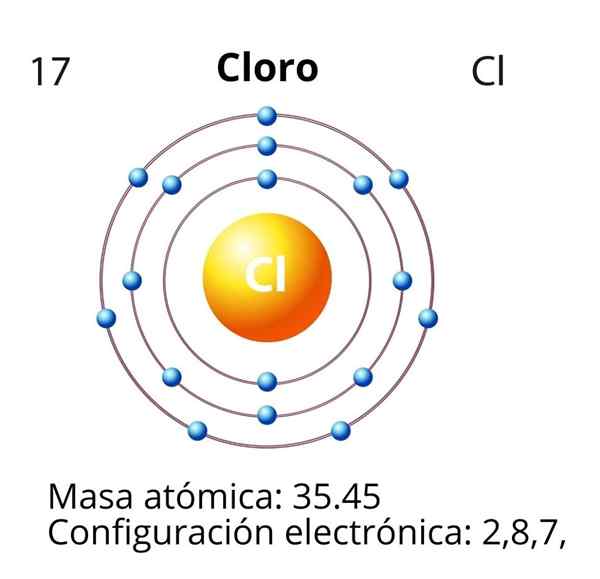
V prípade chlóru (Cl) je jeho atómové číslo Z rovné 17. Elektronická konfigurácia je potom 1s22s2spona63s23p5. Orbitály označené červenou farbou zodpovedajú valenom vo vrstve Valencia, ktorá predstavuje otvorenú úroveň 3.
Diferenciálny elektrón je posledný elektrón, ktorý je umiestnený v elektronickej konfigurácii, a atóm chlóru je atómom orbitálu 3p, ktorého dispozícia je nasledovná:
↑ ↓ ↑ ↓ ↑ _
3px 3py 3pz
(-1) (0) (+1)
Rešpektujúc pravidlo umývadla, orbitály 3p sú najprv naplnené rovnakou energiou (šípka smerom nahor v každej orbitáli). Po druhé, ostatné elektróny sa spoja s osamelými zľava na pravú elektrón. Diferenciálny elektrón je zastúpený v zelenom ráme.
Diferenciálny elektrón chlóru má teda nasledujúce kvantové čísla: (3, 1, 0, -1/2). To znamená, že „n“ je 3; "L" je 1, orbitál "p"; „M“ je 0, pretože je to orbitálna „p“ média; A „s“ je -1/2, pretože šípka smeruje nadol.
Horčík
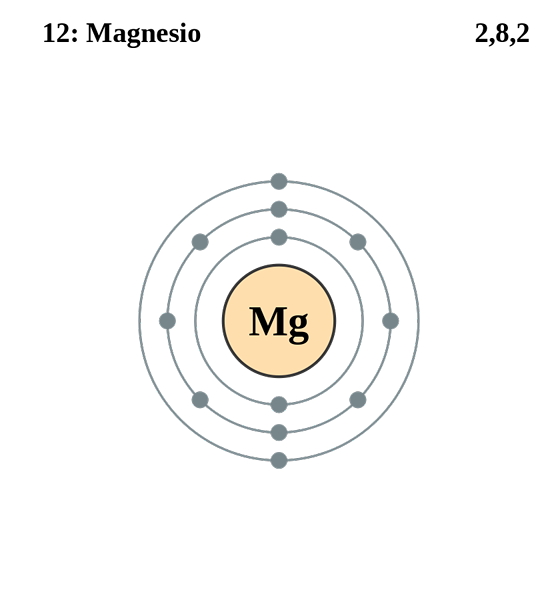 Elektronická konfigurácia horčíka. Zdroj: Electron_shell_012_magnesium.SVG: Pumbaa (originálna práca Grega Robsona) Derivátívne dielo: Kizar, CC BY-SA 3.0, cez Wikimedia Commons
Elektronická konfigurácia horčíka. Zdroj: Electron_shell_012_magnesium.SVG: Pumbaa (originálna práca Grega Robsona) Derivátívne dielo: Kizar, CC BY-SA 3.0, cez Wikimedia Commons Elektronická konfigurácia pre atóm horčíka je 1S22s2spona63s2, Predstavuje orbitál a jeho elektrón Valencia rovnakým spôsobom:
↑ ↓
3s
0
Tentoraz má diferenciálny elektrón kvantové čísla 3, 0, 0, -1/2. Jediným rozdielom v tomto prípade vzhľadom na chlór je, že kvantové číslo „L“ je 0, pretože elektrón zaberá orbitálnu „s“ (3s).
Zirkonio
Elektronická konfigurácia pre atóm zirkónia (prechodný kov) je 1S22s2spona63s23p64s23D104p65s24d2. Rovnakým spôsobom, ako v predchádzajúcich prípadoch je znázornenie orbitálov a elektrónov vo Valencii nasledujúce:
Môže vám slúžiť: Cyclopentano (C5H10): Štruktúra, vlastnosti a použitia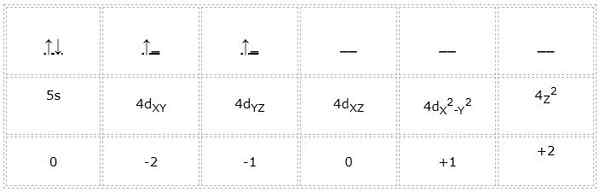
Kvantové čísla pre diferenciálny elektrón označený zelenou farbou sú: 4, 2, -1, +1/2. Tu, keď elektrón zaberá druhý orbitálny „d“, má kvantové číslo „M“ rovné -1. Tiež, pretože šípka ukazuje nahor, jeho číslo spinov „S“ sa rovná +1/2.
Neznámy prvok
Kvantové čísla diferenciálneho elektrónu pre neznámy prvok sú 3, 2, +2, -1/2. Aké je atómové číslo z prvku? Vedieť, že Z môže dešifrovať, čo je to prvok.
Tentoraz, ako „N“ je rovnaký 3, to znamená, že prvok je v tretej perióde periodickej tabuľky, s „D“ orbitálmi ako vrstva Valencie („L“ rovná 2). Preto sú orbitály zastúpené ako v predchádzajúcom príklade:
↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
Kvantové čísla „M“ rovnajúce sa +2 a „s“ rovnajúcim sa -1/2 sú kľúčom k správnemu lokalizácii diferenciálneho elektrónu v poslednom 3D orbitáli.
Vyžiadaný prvok má teda 3D orbitály10 plné, rovnako ako jeho vnútorné elektronické vrstvy. Záverom je, že prvkom je kovový zinok (Zn).
Kvantové čísla diferenciálneho elektrónu však nemôžu rozlíšiť medzi zinkom a meďou, pretože tento posledný prvok tiež predstavuje 3D orbitály plné. Pretože? Pretože meď je kov, ktorý zlyhá s pravidlami vyplnenými elektrónmi z kvantových dôvodov.
Odkazy
- Jim Branson. (2013). Pravidlá umývadla. Zdroj: z QuantumMechanics.Ucsd.Edu
- Prednáška 27: Sinkove pravidlá. Získané z pH.Qmul.Ac.Uk
- Purdue University. Kvantové čísla a konfigurácie elektrónov. Zdroj z Murmeda.Chem.Purdue.Edu
- Salvat Encyclopedia of Science. (1968). Salvat Physics, s.Do. edícií Pamplona, zväzok 12, Španielsko, s. 314-322.
- Walter J. Moore. (1963). Fyzikálna chémia. V Častice a vlny. Štvrté vydanie, Longmans.

