Štruktúra uhličitanu vápenatého, vlastnosti, tvorba, použitie

- 4994
- 653
- Tomáš Mydlo
On uhličitan vápenatý Je to anorganická zlúčenina, ktorej chemický vzorec je Caco3. Nachádza sa hlavne v mineráloch, ako je kalcit a aragonit. Rovnako, vápenec skladá, sedimentárna hornina, v ktorej je prítomný minerál Calcita.
Tento dôležitý kovový uhličitan sa získava priemyselne extrakciou a brúsením minerálov, ktoré ho obsahujú; Na tento účel sa používa hlavne mramor. Ďalší proces spočíva v používaní oxidu vápenatého, ktorý sa stáva hydroxidom vápenatého, ktorý vyráža uhličitan vápenatý pridaním oxidu uhličitého. Týmto spôsobom sa kryštály získavajú zo širokej škály veľkostí.
 Slimák sa skladá hlavne z uhličitanu vápenatého. Zdroj: Pixabay.
Slimák sa skladá hlavne z uhličitanu vápenatého. Zdroj: Pixabay. Môžu sa tiež použiť na priemyselnú výrobu Caco3, V malom rozsahu škrupiny mušlí, škrupiny vajec a lastúry ustrice, v ktorých sú prítomné.
Uhličitan vápenatý prítomný vo vápencovi sa rozpustí oxidom uhličitého vo vode a vytvára hydrogenuhličitan vápenatý. Táto akcia môže spôsobiť jaskyne a je príčinou alkalácie vody; udalosť veľkého významu pri udržiavaní života v ňom.
Používa sa pri výstavbe a vypracovaní sôch; Príkladom toho sú partner Atény, katedrála Krakov a socha Abrahama Lincolna vo Washingtone. Jeho náchylnosť na kyslý dážď však znížila jeho použitie v konštrukcii.
Uhličitan vápenatý mal v priemysle viac aplikácií ako plastový a papierový materiál. V medicíne sa používa na kontrolu kyslosti žalúdka; ako doplnok vápnika v potrave; na kontrolu fospatie u pacientov s chronickým zlyhaním obličiek atď.
[TOC]
Štruktúra
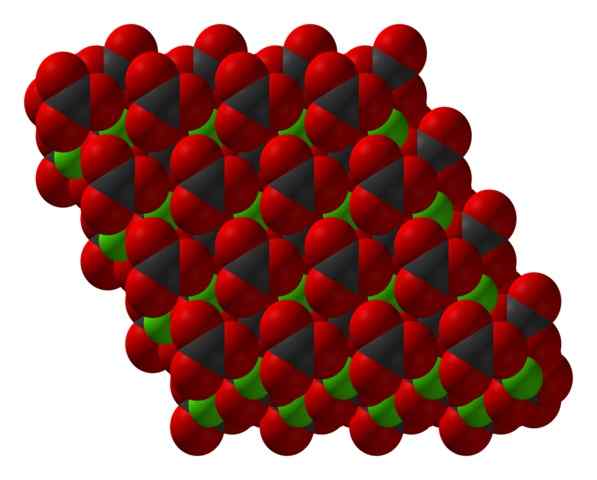 Kryštalická štruktúra Chanco3 predstavovaná modelom výplne priestoru. Zdroj: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Kryštalická štruktúra Chanco3 predstavovaná modelom výplne priestoru. Zdroj: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Vzorca uhličitanu vápenatého, Caco3, naznačuje, že podiel medzi iónmi CA2+ a co32- Je to 1: 1; to znamená pre každú ca2+ Existuje CO32- protistrany s ním elektrostaticky interagovať. Iónová väzba teda končí tým, že tieto ióny vytvárajú štrukturálne vzorce, ktoré definujú kryštál.
Na vynikajúcom obraze je zobrazená štruktúra Caco3. Zelené gule zodpovedajú katiónom CA2+, a červené a čierne gule na spoločné anióny32-. Všimnite si, že štruktúra sa zdá byť tvorená viacerými vrstvami: jedným z vápnika a druhou z uhličitanu; čo znamená, že kryštalizuje v kompaktnej hexagonálnej štruktúre.
Môže vám slúžiť: chlorid amónny (NH4CL)Táto šesťuholníková fáza (p-kako3) Zodpovedá polymorfu. Existujú ďalšie dva: ortorbicka (λ-Caco3) a ešte hustejšie šesťuholníky (μ-Caco3). Spodný obrázok pomáha lepšie vizualizovať šťastný šesťuholník:
 Hexagonálna štruktúra kalcitu. Materialscientist v anglickej Wikipédii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Hexagonálna štruktúra kalcitu. Materialscientist v anglickej Wikipédii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] V závislosti od teploty (a pre túto soľ) sú však ióny vo svojich vibráciách upravené na iné štruktúry; Toto sú vyššie uvedené polymorfy (p, λ a μ).
Pretože znie nie sú dobre známe, pokiaľ nie sú uvedené so svojimi mineralogickými menami v ďalšej časti.
Tvrdosť proteínov
Cacoove kryštály3 Nie sú sami: môžu hostiť nečistoty ako iné kovové katióny, ktoré ich farbia vo farbách; o Proteíny, zahŕňajúce organickú matricu, ktorá nejako prispieva k jej prirodzenej tvrdosti.
Proteíny znižujú napätie, ktoré sa vyskytujú kryštálmi od seba pred tlakom alebo nárazom. Ako? Pri rozptýlení medzi kryštálmi pôsobí, akoby to bola „podložka“ (podobná tehlovej cementovej lady).
Preto je táto zlúčenina alebo minerál biokompatibilná a nie je prekvapené, že je súčasťou nechtov, morských škrupín, škrupín alebo kostí ježkov. Bolo zdrojom inšpirácie pre tých, ktorí sa venujú vývoju nových materiálov.
Vlastnosti
Ostatné mená
-Aragonit
-Calcito
-Volterit
-Vápenaté mlieko
-Biela tabuľa
-Mramor
Molárna hmota
100 086 g/mol.
Fyzický popis
Toaleta s bielym prachom.
Príchuť
Podobne ako v kriede, bez chuti.
Fúzne a varné body
Rozkladá sa, pretože uvoľňuje CO2 pred dokonca topením alebo varením.
Rozpustnosť
Prakticky nerozpustné vo vode a alkoholu. Rozpúšťa sa s šumivou v zriedenom kyseline octovej a kyseliny chlorovodíkovej. Hydroxidy však znižujú svoju rozpustnosť. Medzitým amónne soli a oxid uhličitý zvyšujú rozpustnosť uhličitanu vápenatého vo vode.
Hustota
2,7 až 2,95 g/cm3.
Rozklad
Okolo 825 ° C sa rozdelí na oxid vápenatý (vápno) a oxid uhličitý (CO2).
pH
8 až 9
Index lomu
-1 7216 až 300 nm a 1 6584 až 589 nm (Calcita).
-1 5145 až 300 nm a 1 4864 až 589 nm (aragonit).
Nekompatibilita
S kyselinami, hliníkmi a amónnymi.
Fúzia
36 kJ/mol pri 800 ° C (kalcit).
Môže vám slúžiť: molarita: koncentrácia, jednotky, výpočet, cvičeniaKonštanta produktu rozpustnosti
3,36 · 10-9 pri 25 ° C.
Tvrdosť
-3,0 (kalcit)
-3,5 - 4,0 (aragonit) na stupnici Mohs.
Fázové prechody
Aragonit je metastabilný a nezvratne sa mení na kalcit, keď ho zahrieva v suchom vzduchu na 400 ° C.
Reaktivita
Uhličitan vápenatý reaguje s kyselinami, uvoľňuje oxid uhličitý, iónový vápnik a voda.
Uhličitan vápenatý sa kombinuje s nasýtenou vodou s oxidom uhličitým, čo je ekvivalentná kyseline uhličitej (H2Co3), Na vytvorenie hydrogenuhličitanu vápenatého.
Výcvik
Krieda, mramor a vápenec, prvé dva minerály a skalný materiál tretí, obsahujú uhličitan vápenatý a sú sedimentárneho pôvodu, predpokladá sa, že sú tvorené sedimentáciou slimákov na milióny rokov rokov.
PH by mohlo byť najdôležitejším faktorom pri tvorbe polymorfov pri teplote 24 ° C. Vaterita je hlavným produktom v rozmedzí pH medzi 8,5 a 10; Aragonit je pH 11; a kalcit na pH> 12.
Je tiež známe, že mnoho sladkovodných rias vytvára kryštály kalcitu, keď rastú v prostredí nasýtených vápnikmi. Okrem toho sú mikro riasy schopné spôsobiť zrážanie uhličitanu vápenatého.
Uhličitan z vápenatého
Na obrázkoch nižšie sa pre tri hlavné tvary alebo polymorfy zobrazia pre uhličitan vápenatý:
 Kalcita. Zdroj: Rodič Géry [verejná doména]
Kalcita. Zdroj: Rodič Géry [verejná doména] Aragonitový kryštál. Zdroj: Battistini Riccardo [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Aragonitový kryštál. Zdroj: Battistini Riccardo [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Kryštály. Zdroj: Rob Lavinsky, Irocks.com-ccy-SA-3.0 [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Kryštály. Zdroj: Rob Lavinsky, Irocks.com-ccy-SA-3.0 [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Z zhora nadol sú polymorfy kalcitu, aragonitu a vaterita. Všimnite si rozdiel medzi morfológiou ich kryštálov (farba je typická pre jeho pôvod a vlastnosti jeho prostredia).
Vaterita je viac nepriehľadná ako kalcit, druhý sa stáva dokončením. Medzitým sa kryštály aragonitu pripomínajú malé predĺžené monolity.
Ak sa vzorky týchto troch polymorfov pozorujú pod elektronickým mikroskopom, ich kryštály (sivých tónov, pretože táto technika neumožňuje rozlíšenie farieb), rovnaké morfológie by sa našli ako v makroskopických mierkach; to znamená na prvý pohľad.
Medzi týmito tromi polymorfami je kalcit najčastejšie a najstabilnejší, po ktorom nasleduje aragonit a nakoniec vaterita, najvzácnejšia forma Caco3
Môže vám slúžiť: kalorimetria: aké štúdie a aplikácieŽiadosti
Priemyselný pracovník
Uhličitan vápenatý zvyšuje odolnosť voči torzii a trakcii syntetického a prírodného gumy, čím sa zachováva jeho flexibilita. Používa sa v stavebnom priemysle ako cementová zložka a ako surovina pre vápno. Jeho použitie sa znížilo, pretože je poškodené kyslým dažďom.
Uhličitan vápenatý sa používa pri čistení železa. Vo forme vápna eliminuje oxid siričitý prítomný v kovu. Používa sa čistenie cukru repa. Používa sa ako krieda pre bridlicu, ale pre túto aplikáciu bola nahradená omietkou.
Uhličitan vápenatý sa zmieša s tmelom použitým pri umiestnení skla. Zem sa používa ako náplňový materiál v mikroporéznom filme používanom v plienkach. Používa sa tiež ako náplňový materiál v plastoch, ako je PVC. Okrem toho sa zvyšuje pevnosť plastov.
Uhličitan vápenatý sa používa na zvýšenie kapacity pokrytia obrazov. Používa sa ako materiál na výplň papiera, pretože je lacnejší ako drevené vlákno, ktorý je schopný reprezentovať viac ako 10% papiera.
Lekári
Používa sa ako antacid na boj proti žalúdočnej hyperaciity a zmiernenie trávenia. Používa sa ako doplnok vápnika v potrave a pri liečbe a prevencii osteoporózy. Používa sa pri liečbe hyperfosfázy u pacientov s chronickým zlyhaním obličiek.
Používa sa na zníženie nežiaducich účinkov proteázových inhibítorov používaných pri liečbe HIV, pozoruje u pacientov zníženie hnačky.
Vyvoláva pokles krvného tlaku u tehotných žien s hypertenziou a preeklampsiou, pretože obidve by mohli byť spojené so zvýšením dopytu po vápniku v dôsledku prítomnosti plodu.
Ďalší
Uhličitan vápenatý sa používa v poľnohospodárstve ako hnojivo a na boj proti kyslosti pôdy. Používa sa ako konzervačný, farebný držiak a opätovné potvrdenie potravín.
Okrem toho je prísadou zubnej pasty a slúži ako brúsivá pri čistení a umývaní.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Uhličitan vápnik. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2019). Uhličitan vápnik. Databáza pubchem., CID = 10112. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Kai-yin Chong, Chin-Hua Chia a Sarani Zakaria. (2014). Polymorfy vápenatý uhličitan pri teplotnej reakcii. Zborník konferencie AIP 1614, 52; doi.org/10.1063/1.4895169
- Greg Watry. (1. novembra 2016). Objavenie kryštálov uhličitanu Howum Získajte silu. Výhoda obchodného marketingu. Obnovené z: rdmag.com
- Americké prvky. (2019). Uhličitan vápnik. Zdroj: Američania.com
- Elsevier. (2019). Uhličitan vápnik. Vedecký. Zdroj: ScienceDirect.com
- Chemická kniha. (2017). Uhličitan vápnik. Obnovené z: Chemicalbook.com

