Zmeny typov stavu a ich charakteristiky (s príkladmi)
- 2783
- 179
- Denis Škriniar
Ten zmeny stavu alebo fáza je termodynamický jav, v ktorom sa vyskytujú reverzibilné fyzické zmeny. Hovorí sa, že je termodynamický, pretože medzi hmotou a okolím dochádza k prenosu tepla; Alebo čo je to isté, existujú interakcie medzi hmotou a energiou, ktoré indukujú preskupenie častíc.
Častice, ktoré zažívajú zmenu stavu, zostávajú rovnaké pred a po ňom. Tlak a teplota sú dôležitými premennými v tom, ako sú umiestnené v jednej alebo druhej fáze. Ak dôjde k zmene štátu, vytvorí sa dvojfázový systém, ktorý sa skladá z rovnakej hmoty v dvoch rôznych fyzických stavoch.
 Zmeny stavu. Zdroj: Gabriel Bolívar
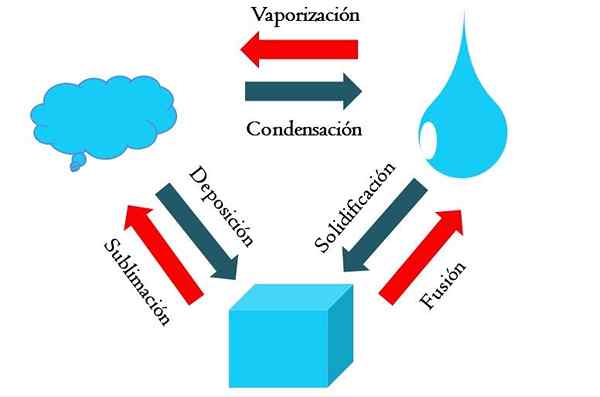
Zmeny stavu. Zdroj: Gabriel Bolívar Vyšší obrázok ukazuje hlavné zmeny stavu, ktoré majú záležitosť za normálnych podmienok.
Pevná kocka modrej látky sa môže stať kvapalnou alebo plynnou v závislosti od teploty a tlaku jej okolia. Sama o sebe predstavuje jednu fázu: tuhá látka. Ale v čase topenia to znamená topenie, rovnováha tuhej kvapaliny nazývaná fúzia (červená šípka medzi vedrom a modrou kvapkou je vytvorená).
Aby sa fúzia vyskytla, kocka musí absorbovať teplo zo svojho okolia, aby sa zvýšila jeho teplota; Preto je to endotermický proces. Akonáhle je kocka roztavená, je to opäť jedna fáza: fáza kvapalného stavu.
Táto blota môže naďalej absorbovať teplo, čo zvyšuje jeho teplotu a vedie k tvorbe plynných bublín. Opäť existujú dve fázy: jedna tekutina a druhá sóda. Keď sa všetka tekutina odparila svojím bodom varu, potom sa hovorí, že varila alebo odparovala.
Teraz sa moderné kvapky zmenili na oblaky. Doteraz boli všetky procesy endotermálne. Bluish Gas môže naďalej absorbovať teplo, až kým sa nezohrieva; Vzhľadom na suchozemské podmienky to však má tendenciu opäť ochladiť a kondenzovať v kvapaline (kondenzácia).
Na druhej strane oblaky môžu byť tiež uložené priamo v tuhej fáze, čím sa opäť tvoria pevná kocka (depozícia). Tieto posledné dva procesy sú exotermické (modré šípky); to znamená, že uvoľňujú teplo do prostredia alebo okolo.
Okrem kondenzácie a ukladania došlo k zmene stavu, keď blota zamrzne pri nízkych teplotách (tuhosť).
[TOC]
Typy zmien stavu a ich vlastnosti
Obrázok ukazuje typické zmeny pre tri (najbežnejšie) stavy hmoty: pevné, kvapalné a plynné. Zmeny sprevádzané červenými šípkami sú endotermické, naznačujú absorpciu tepla; Zatiaľ čo tie sprevádzané modrými šípkami sú exotermické.
Stručný opis každej z týchto zmien bude uvedený nižšie a zdôrazní niektoré jeho charakteristiky z molekulárneho a termodynamického zdôvodnenia.
- Fúzia
Fúzia je zmena stavu látky z tuhého stavu na kvapalinu.

V tuhom stave častice (ióny, molekuly, zhluky atď.) sú „väzni“, ktoré sa nachádzajú v pevných pozíciách priestoru bez toho, aby sa mohli voľne pohybovať. Sú však schopní vibrovať pri rôznych frekvenciách, a ak sú veľmi silné, dôkladný poriadok uložený intermolekulárnymi silami sa začne „rozpadať“.
Výsledkom je, že sa získajú dve fázy: jedna, kde sa častice naďalej obmedzujú (pevné) a druhá, kde sú slobodnejšie (kvapalina), dosť na zvýšenie vzdialeností, ktoré ich od seba oddeľujú. Aby sa to dosiahlo, tuhá látka musí absorbovať teplo, a tak jej častice budú vibrovať s väčšou silou.
Môže vám slúžiť: atómová hmotnosť: definícia, typy, ako ho vypočítať, príkladyZ tohto dôvodu je fúzia endotermická, a keď sa začne, hovorí sa, že dochádza k rovnováhe medzi fázami tuhej látky.
Teplo potrebné na vyvolanie tejto zmeny sa nazýva entalpia tepla alebo topenia (δHFus). Tým sa vyjadruje množstvo tepla (energia, hlavne v jednotkách KJ), ktoré musia absorbovať krtek látky v tuhom stave, aby sa topil, a nielen zvyšuje jeho teplotu.
Snehová guľa
 Topenie snehom rukou. Zdroj: Pixabay
Topenie snehom rukou. Zdroj: Pixabay S ohľadom na to sa chápe, prečo sa v ruke topí snehová guľa (vynikajúci obraz). Sneh absorbuje telesné teplo, čo je dostatočné na zvýšenie teploty snehu nad 0 ° C.
Ľadové kryštály prítomné v snehu absorbujú pravé teplo, aby sa topil, a tak, že ich molekuly vody prijali nepokojnejšiu štruktúru. Kým sa sneh topí, vytvorená voda nezvýši svoju teplotu, pretože všetky teplo ruky využíva sneh na dokončenie svojej fúzie.
- Odparovanie

Odparovanie je zmena stavu látky z kvapalného stavu na plynný.
Pokračovanie v príklade vody, teraz vkladanie hrsti snehu do hrnca a zapálil oheň, je pozorované, že sneh sa rýchlo roztopí. Keď sa voda zahrieva, začnú tvoriť malé bubliny oxidu uhličitého a ďalšie možné nečistoty plynu.
 Vriaca voda. Zdroj: Pixabay
Vriaca voda. Zdroj: Pixabay Tepelne dilatované molekulárne nepokojné konfigurácie vody, rozširujú jej objem a zvyšujú tlak pary; Preto existuje niekoľko molekúl, ktoré unikajú z povrchového produktu zvyšujúceho sa odparovania.
Kvapalná voda zvyšuje svoju teplotu pomaly kvôli vysokému špecifickému tepla (4 184J/° C ∙ g) g) g) g) g) g) g) g) g) g) g) g) g) g). Existuje bod, v ktorom teplo, ktoré sa absorbuje, ho už nepoužíva na zvýšenie svojej teploty, ale na začatie rovnováhy kvapaliny-vapor; To znamená, že sa začína variť a všetka kvapalina prechádza do plynného stavu, pričom absorbuje teplo a udržiava teplotnú konštantu.
Tu sa pozoruje intenzívna bublina na povrchu varenej vody (vynikajúci obraz). Teplo, ktoré absorbuje kvapalnú vodu tak, aby sa tlak pary jej počiatočných bublín rovnocenný vonkajším tlakom, nazýva Entalpia odparovania (AHVrece).
Úloha tlaku
Tlak je tiež rozhodujúci pri zmenách štátu. Aký je jeho vplyv na odparovanie? Že pri väčšom tlaku, čím väčšie je teplo, ktoré musí absorbovať vodu, aby sa uvarila, a preto sa odparuje nad 100 ° C.
Je to preto, že zvýšenie tlaku sťažuje únik z molekúl vody z kvapalnej fázy do sódy.
Tlakové hrnce používajú túto skutočnosť v ich prospech na zahrievanie potravín vo vode pri teplote nad bodom varu.
Na druhej strane, s vákuom alebo znížením tlaku, kvapalná voda potrebuje nižšiu teplotu, aby sa uvarila a presunula do plynovej fázy. S veľkým alebo malým tlakom potrebuje v čase varenia voda absorbovať jej príslušné odparovanie, aby sa dokončila zmena stavu.
- Kondenzácia
Kondenzácia je zmena stavu látky z plynného stavu na kvapalný stav.
Môže vám slúžiť: galaktóza
Voda sa odparila. Čo bude ďalej? Vodná para môže stále zvýšiť svoju teplotu a stať sa nebezpečným prúdom schopným spôsobiť vážne popáleniny.
Namiesto toho však predpokladajme, že sa ochladí. Ako? Uvoľňovanie tepla do životného prostredia a pri uvoľňovaní tepla sa hovorí, že sa deje exotermický proces.
Uvoľňovaním tepla sa začnú spomaľovať samotné energetické plynné molekuly. Jeho interakcie tiež začínajú byť efektívnejšie, keď teplota pary klesá. Najprv sa vytvoria kvapky vody, kondenzát pary, po ktorých budú mať väčšie kvapky, ktoré nakoniec priťahujú gravitáciu.
Ak chcete úplne odsúdiť určité množstvo pary, musíte uvoľniť rovnakú energiu, ale s opačným znakom, pri AHVrece; to znamená, že jej kondenzačná entalpia ΔHOdsúdiť. Preto je spätná rovnováha pary-kvapaliny stabilná.
Vlhkosť
 Kondenzácia vody. Zdroj: pexels
Kondenzácia vody. Zdroj: pexels Kondenzáciu je možné pozorovať v samotných oknách domácností. V chladnom počasí sa vodná para obsahuje vo vnútri domu s oknom, ktoré má podľa jeho materiálu nižšiu teplotu ako iné povrchy.
Tam je ľahšie zoskupenie molekúl pary, čím sa ručne ľahko vyberie tenká belavá vrstva. Keď tieto molekuly uvoľňujú teplo (vykurovacie sklo a vzduch), začnú tvoriť početnejšie zhluky, až kým nedokážu kondenzovať prvé kvapky (horný obrázok).
Keď kvapky výrazne zväčšujú svoju veľkosť, skĺznú cez okno a zanechajú vodnú stopu.
- Tulifikácia
Solidifikácia je zmena stavu látky z kvapalného stavu na tuhý stav.

Solidifikácia dochádza v dôsledku chladenia; Inými slovami, voda zamrzne. Na zmrazenie, voda musí uvoľniť rovnaké množstvo tepla, ktorý absorbuje ľad na topenie. Toto teplo sa opäť nazýva tudifikácia alebo zmrazenie entalpie, ΔHKong (-5hFus).
Pri ochladení molekuly vody strácajú energiu a ich intermolekulárne interakcie sa stávajú silnejšími a smerom. V dôsledku. Mechanizmus, ktorým ľadové kryštály rastú na ich vzhľad: priehľadné alebo biele.
 Ľadová socha. Zdroj: Pixabay
Ľadová socha. Zdroj: Pixabay Ak ľadové kryštály rastú veľmi pomaly, tieto neobsahujú nečistoty, napríklad plyny, ktoré sú pri nízkych teplotách solubilizované vo vode. Bubliny tak unikajú a nemôžu interagovať so svetlom; A preto existuje ľad taký priehľadný ako ľad mimoriadna socha ľadu (vynikajúci obraz).
To isté, čo sa deje s ľadom, sa môže stať s akoukoľvek inou látkou, ktorá stuhne ochladením. Možno je to najzložitejšia fyzická zmena v pozemských podmienkach, pretože je možné získať niekoľko polymorfov.
- Sublimácia
Sublimácia je zmena stavu látky z pevnej látky na plyn.

Môže voda podprubina? Nie, aspoň nie za normálnych podmienok (t = 25 ° C, p = 1 atm). Pri sublimácii dochádza, to znamená, že zmena stavu plynu musí byť tlak pary vysoký.
Podobne je nevyhnutné, aby ich intermolekulárne sily nie sú príliš silné, pokiaľ ide o disperzné sily
Najpriamejším príkladom je solídny jód. Je to kryštalická pevná látka šedo-morálnych tónov, ktorá má vysoký tlak pary. To je také, že vo svojom konaní nasleduje fialová para, ktorej objem a expanzia sú pozoruhodné, keď sa otepľuje.
Môže vám slúžiť: trialamín: štruktúra, vlastnosti, použitia a riziká Sublimácia jódu. Zdroj: Belkina N V [CC po 4.0 (https: // creativeCommons.Org/licencie/o/4.0)], z Wikimedia Commons
Sublimácia jódu. Zdroj: Belkina N V [CC po 4.0 (https: // creativeCommons.Org/licencie/o/4.0)], z Wikimedia Commons Na hornom obrázku je zobrazený typický experiment, kde sa v sklenenej nádobe odparuje tuhý jód. Je zaujímavé a pozoruhodné pozorovať, ako sa šíria fialové pary, a iniciovaný študent môže overiť neprítomnosť tekutého jódu.
Toto je hlavná charakteristika sublimácie: neexistuje žiadna prítomnosť kvapalnej fázy. Je tiež endotermická, pretože tuhá látka absorbuje teplo, aby sa zvýšil tlak pary, aby sa rovnal vonkajšiemu tlaku.
- Depozícia
 Iodo krištáľový depozícia. Zdroj: Stanislav.Nevyhosteny [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons
Iodo krištáľový depozícia. Zdroj: Stanislav.Nevyhosteny [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons Depozícia je zmena stavu látky z plynného stavu do pevného stavu.
Paralelne s experimentom sublimácie jódu, máte ukladanie. Depozícia je opačná zmena alebo prechod: látka prechádza z plynného stavu na tuhú látku bez tvorby kvapalnej fázy.
Keď jódové fialové výpary prídu do styku so studeným povrchom, uvoľňujú teplo, aby ho zahreli, strácajú energiu a preskupujú svoje molekuly opäť v sivej pevnej látke šedej (vynikajúci obraz). Je to potom exotermický proces.
Depozícia sa široko používa na syntézu materiálov, kde dopingujú atómy kovov prostredníctvom sofistikovaných techník. Ak je povrch veľmi chladný, výmena tepla medzi ním a parnými časťami je náhla, a vynecháva priechod cez príslušnú kvapalnú fázu.
Teplo alebo entalpia depozície (a nie Depozícia) je sublimácia (ΔHPonorka=- ΔHD.E.P). Teoreticky sa dajú sublimovať početné látky, ale na dosiahnutie tohto cieľa je potrebné manipulovať s tlakami a teplotami, okrem toho, že má k dispozícii svoj diagram P vs T; v ktorých je možné vizualizovať ich vzdialené možné fázy.
Ďalšie zmeny štátu
Aj keď nie sú uvedené, existujú aj iné stavy hmoty. Niekedy sú charakterizované tým, že majú „trochu každého z nich“, a preto ich kombináciou. Na ich generovanie by sa tlaky a teploty mali manipulovať s veľmi pozitívnymi (veľkými) alebo negatívnymi (malými) veľkicami.
Napríklad, ak sa plyny výrazne zahrievajú, stratia svoje elektróny a svoje pozitívne zaťažené jadrá v tomto negatívnom prílivu budú predstavovať to, čo je známe ako plazma. Je to synonymum pre „elektrický plyn“, pretože predstavuje vysokú elektrickú vodivosť.
Na druhej strane, keď teploty zostupujú príliš veľa, záležitosť sa môže správať nepravdepodobne; To znamená, že vykazujú jedinečné vlastnosti okolo Absolute Zero (0 K).
Jednou z týchto vlastností je nadprodukt a supravodivosť; ako aj tvorba kondenzátu Bose-Einstein, kde sa všetky atómy správajú ako jeden.
Dokonca aj niektoré vyšetrovania poukazujú na fotonické záležitosti. V nich sú častice elektromagnetického žiarenia, fotóny, zoskupené tak, aby tvorili fotonické molekuly. To znamená, že by to teoreticky dalo hmotnosť niektorým telám svetla.
Odkazy
- HelMestine, Anne Marie, PH.D. (19. novembra 2018). Zoznam fázových zmien medzi stavom hmoty. Zotavené z: Thoughtco.com
- Wikipedia. (2019). Stav hmoty. Zdroj: In.Wikipedia.orgán
- Dorling Kindersley. (2007). Meniaci sa stav. Získané z: FactMonster.com
- Meyers Ami. (2019). Zmena fázy: odparovanie, kondenzácia, frezing, topenie, sublimácia a depozícia. Štúdium. Získané z: štúdie.com
- Bagley M. (11. apríla 2016). Záležitosť: Definícia a päť stavu hmoty. Zotavené z: Livescience.com
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- « Druhý zákon termodynamiky, rovnice, príklady
- Štruktúra jodidu draselného (KI), vlastnosti, získanie, použitie, riziká »

