Štruktúra jodidu draselného (KI), vlastnosti, získanie, použitie, riziká

- 3744
- 634
- Alfréd Blaho
On jodid draselného Je to anorganická zlúčenina tvorená iónom draslíka (k+) a jodidový ión (i-). Jeho chemický vzorec je ki. Je to biela kryštalická pevná látka, iónovej povahy a je veľmi rozpustná vo vode.
KI umožňuje niekoľko chemických reakcií a analýzy a používa sa na meranie množstva ozónu v atmosfére. Používa sa tiež v infračervenom analýze zariadení (IR).
 Tuhý jodid draselný. Ondřej Mangl [verejná doména]. Zdroj: Wikimedia Commons.
Tuhý jodid draselný. Ondřej Mangl [verejná doména]. Zdroj: Wikimedia Commons. Jodid draselného sa pridáva k spoločnej stolovej soli, aby sa zabránilo nedostatku jódu u ľudí, pretože to môže predstavovať vážny zdravotný problém.
Používa sa ako expektorant, pretože pomáha, aby hlien mohol ľahko prúdiť z dýchacích kanálov vonku. Slúži tiež na liečbu niektorých hubových infekcií a používa sa v niektorých kozmetike.
Používajú ho veterinárni lekári na liečbu problémov podobných problémom ľudí, ako sú kašeľ a kožné infekcie. Dokonca sa pridáva vo veľmi malých množstvách zvieratám pre zvieratá.
[TOC]
Štruktúra
Jodid draselný je iónová zlúčenina tvorená katiónom draslíka k+ A anión Yoduro i-, Preto je medzi nimi spojenie iónové. Stav oxidácie draselného je +1 a Valencia del jód je -1.
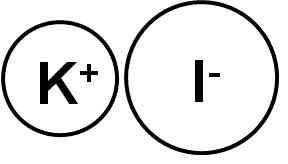 Jodid draselný je iónová zlúčenina. Autor: Marilú Stea.
Jodid draselný je iónová zlúčenina. Autor: Marilú Stea. Kryjodidové kryštály draselného ki sú kubické.
 Štruktúra jodidu draselného. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
Štruktúra jodidu draselného. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. Menovanie
- Jodid draselného
- Jodid draselného
Vlastnosti
Fyzický stav
Kryštalická biela pevná látka. Kubické kryštály.
Molekulová hmotnosť
166 003 g/mol
Bod topenia
681 ° C
Bod varu
1323 ° C
Hustota
3,13 g/cm3
Rozpustnosť
Veľmi rozpustné vo vode: 149 g/100 g vody pri 25 ° C. Mierne rozpustný v etanole a éteri.
Môže vám slúžiť: Neón: História, vlastnosti, štruktúra, riziká, použitiepH
Jeho vodné roztoky sú neutrálne alebo zásadité, s pH medzi 7 a 9.
Chemické vlastnosti
Mierne hygroskopický vo vlhkom vzduchu.
Je stabilný v suchom vzduchu. Svetlo a vlhkosť urýchľujú jeho rozklad a jeho farbu sa zmení na žltú v dôsledku uvoľňovania malých množstiev jódu (i2) a yodatos (io3-).
Ki vodné roztoky sa časom tiež žltnú, s trochou alkaliho, ktorým sa dá vyhnúť.
Tieto roztoky sa rozpúšťajú na jód (i2) Dávať ki3:
Jo- + Jo2 → i3-
Ďalšie vlastnosti
Má silne horkú a soľnú chuť. Nie je to horľavé.
Získanie
Jodid draselný sa dá získať zahrievaním jódu (i2) V koncentrovanom roztoku hydroxidu draselného (KOH):
3 i2 + 6 koh → 5 ki + kio3 + H2Ani
Výsledný roztok Yodato a jodid sa zahrieva na odstránenie vody, redukuje sa na suchosť, uhlie sa pridá a zahrieva pri vysokej teplote. Uhlie berie kyslík z jodátu a oxiduje oxid uhličitý, čím sa redukuje jodid na jodid:
2 kio3 + C → 2 ki + 3 co2
Získaný jodid draselný sa môže rekódovať, aby sa ho očistil. To znamená, že je znovu objavený vo vode a vyvoláva opäť kryštalizáciu.
Žiadosti
Pri liečbe hypertyreózy
Jodid draselného slúži ako dodatočná liečba spolu s ďalšími antithyroidnými činidlami na liečbu hypertyreózy.
Hypertyreóza je ochorenie, ktoré spôsobuje, že štítna žľaza vyvoláva príliš veľa hormónu štítnej žľazy so zvýšenou veľkosťou štítnej žľazy, zníženou hmotnosťou osoby, zrýchleným srdcom a podráždenosťou, okrem iných príznakov.
 Žena so zapálenou štítnou žľazou. Môže byť ošetrený jodidom Ki draselným. https: // www.Myupchar.com/in [CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Žena so zapálenou štítnou žľazou. Môže byť ošetrený jodidom Ki draselným. https: // www.Myupchar.com/in [CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. U pacientov s hypertyreózou KI rýchlo znižuje príznaky, pretože inhibuje uvoľňovanie hormónu štítnej žľazy.
Jeho účinky štítnej žľazy sú: Znížené množstvo krvných ciev žľazy, opätovné potvrdenie ich tkanív a zníženie veľkosti ich buniek.
Z tohto dôvodu sa uplatňuje ako predoperačná liečba na vyvolanie involúcie alebo zníženia veľkosti štítnej žľazy pred tyreoidektómiou (odstránenie štítnej žľazy), pretože táto operácia je uľahčená.
Môže vám slúžiť: Sodík: História, štruktúra, vlastnosti, riziká a použitieV iných lekárskych aplikáciách
Jodid draselný má existujúce vlastnosti, keď sa zvyšuje sekrécia respiračných tekutín, čo vedie k zníženej viskozite hlienu.
 Jodid draselný môže pôsobiť ako expektorant pri liečbe kašľom. Autor: анастаball геп. Zdroj: Pixabay.
Jodid draselný môže pôsobiť ako expektorant pri liečbe kašľom. Autor: анастаball геп. Zdroj: Pixabay. Slúži na liečbu nodoso erytému, ktorý je bolestivým zápalom v nohách, v ktorých sa tvoria sčervené uzliny a zvýšená teplota.
Je agent antihongos. Umožňuje liečiť sporotrózu, ktorá je kožnou infekciou spôsobenou hubou. Táto choroba sa stáva ľuďom, ktorí pracujú s rastlinami a pôdou, ako sú poľnohospodári a záhradníci.
Používa sa tiež pri liečbe deficitu jódu alebo na zabránenie tomu, a preto pridáva k stolovej soli alebo jedlej soli (chlorid sodný) ako zdroj jódu a niekedy vo vode na pitie na pitie.
Vo veterinárnych aplikáciách
Jodid draselného sa podáva zvieratám ako protiuvatívny, na zvýšenie a skvapalnenie tekutín dýchacích ciest, pre bronchiálny chronický kašeľ, ako aj v prípade reumatizmu a ako protizápalový.
Slúži tiež na mykózu (plesňové infekcie) zvierat, na zníženie svrbenia a chronickej otrava olova alebo ortuti.
Pri ochrane štítnej žľazy v rádioaktívnych mimoriadnych udalostiach
Jodid draselný má ochranné vlastnosti štítnej žľazy v prípade, že osoba bola vystavená jadrovému žiareniu.
Ki zaplavia štítnu žľazu ne -rradioaktívnym jódom, čím blokuje užívanie rádioaktívnych molekúl a absorpciu rádioaktívneho jódu, čím chráni štítnu žľazu pred rakovinou, ktorá môže spôsobiť žiarenie.
V ozóne opatrení v atmosfére
Ozónový plyn (alebo3) Môže sa merať v atmosfére pomocou elektrolytických buniek nazývaných ozonosandas, ktoré sú transportované pomocou rádiosondových balónov.
Môže vám slúžiť: benchilo benzoateTieto elektrolytické bunky obsahujú roztok jodidu draselného KI. Bunky sú spočiatku v chemickej a elektrickej rovnováhe.
Keď vzorka vzduchu s ozónom (alebo3) Preniká jednou z buniek. Rovnováha je porušená, pretože nastane nasledujúca reakcia:
2 ki + alebo3 + H2O → i2 + Ani2 + 2 koh
Táto reakcia vytvára elektrický prúd, ktorý tečie medzi bunkami.
Množstvo vyrobeného elektrického prúdu sa nepretržite prenáša rádiovými vlnami na stanicu na súši. Týmto spôsobom sa získa profil ozónu, ktorý je od zeme do výšky lopty.
 Balón Take -off s Radiosonda s Ki na meranie ozónu. Hannes Grobe 19:27, 20. júna 2007 (UTC), Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Nemecko [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/2.5)]. Zdroj: Wikimedia Commons.
Balón Take -off s Radiosonda s Ki na meranie ozónu. Hannes Grobe 19:27, 20. júna 2007 (UTC), Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, Nemecko [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/2.5)]. Zdroj: Wikimedia Commons. Na niekoľkých použitiach
Jodid draselný tiež umožňuje:
- Eliminácia voľných radikálov, ako je hydroxylové radikálne OH.
- Výroba fotografických emulzií, aby sa zrážalo striebro.
- Zlepšiť krmivo pre zvieratá, keď sa pridajú v mikrokontitinách.
- Dezodorizovať hnojivo.
- Prejdite infračervené spektrum svetla v zariadení IR Analysis Equipment.
- Vykonajte určité chemické reakcie a analýzu v chemických laboratóriách.
- Používajte ho v osobných hygienických výrobkoch.
- Vykonajte analýzu znečistenia životného prostredia.
Riziká
Niektorí ľudia citliví na jodid.
Ľudia s tuberkulózou alebo akútnou bronchitídou by mali byť tiež opatrní.
Ki môže spôsobiť zmäkčenie slinných žliaz, môže spáliť ústa alebo krk, nezvyčajné zvýšenie slinenia, bolesti zubov a zápal ďasien a kovovej chuti, okrem iných príznakov.
Môžete tiež dráždiť oči a otvoriť rany na pokožke.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Jodid draselného. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Štvrté vydanie. John Wiley & Sons.
- Dean, J.Do. (editor). (1973). Langeova príručka chémie. Vydanie elementu. McGraw-Hill Book Company.
- Valkovic, v. (2019). Dekontaminácia po vystavení žiareniu. Najcitlivejšie časti tela. V rádioaktivite v prostredí (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Smit, h.G.J. (2015). Chémia atmosféry pozorovania chémie (in situ). V encyklopédii atmosférických vied (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Muralikrishna, i.Vložka. a Manickam, v. (2017). Analytické metódy na monitorovanie opeľovania životného prostredia. V environmentálnom riadení. Zotavené z vedeckých pracovníkov.com.
- Wallace, J.M. a Hobbs, P.Vložka. (2006). Atmosférická chémia 1. V atmosférickej vede (druhé vydanie). Zotavené z vedeckých pracovníkov.com.

