Citlivý koncept tepla, vzorce a cvičenia vyriešené

- 1812
- 186
- Blažej Hrmo
On Citlivé teplo Je to tepelná energia dodávaná na objekt, ktorý spôsobuje zvýšenie jeho teploty. Je to opak latentného tepla, v ktorom tepelná energia nezvyšuje teplotu, ale podporuje fázovú zmenu, napríklad z pevnej na kvapalnú.
Príklad objasňuje koncept. Predpokladajme, že máme hrniec s teplotou vody 20 ° C. Keď ho umiestnime do rohu, dodávané teplo zvyšuje teplotu vody pomaly na 100 ° C (teplota varu vody pri hladine mora). Dodávané teplo sa nazýva citlivé teplo.
 Teplo, ktoré ohrieva vaše ruky, je citlivé teplo. Zdroj: Pixabay
Teplo, ktoré ohrieva vaše ruky, je citlivé teplo. Zdroj: Pixabay Akonáhle voda dosiahne teplotu varu, teplo dodávané Hornilla už nezvyšuje teplotu vody, ktorá zostáva pri 100 ° C. V tomto prípade sa dodávaná tepelná energia investuje do odparovania vody. Dodávané teplo je latentné, pretože nezvýšilo teplotu, ale spôsobilo zmenu kvapalnej fázy do plynovej fázy.
Je experimentálnou skutočnosťou, že citlivé teplo potrebné na dosiahnutie určitej teplotnej variácie je priamo úmerná tejto variácii a hmotnosti objektu.
[TOC]
Koncept a vzorce
Bolo pozorované, že okrem hmotnostného a teplotného rozdielu závisí aj citlivé teplo od materiálu. Z tohto dôvodu sa primeranosť konštanty medzi citlivým teplom a produktom hmotnosti pomocou teplotného rozdielu nazýva špecifické teplo.
Množstvo dodaných citlivých tepla tiež závisí od toho, ako sa proces vykonáva. Napríklad sa líši, ak sa proces vykonáva pri konštantnom objeme ako konštantný tlak.
Vzorec pre citlivé teplo v procese izobarický, To znamená konštantný tlak, je to takto:
Q = CP . m (tF - TónJo)
V predchádzajúcej rovnici Otázka Je to citlivé teplo dodávané do hmotnostného objektu m, To zvýšilo svoju počiatočnú teplotu TónJo Do konečnej hodnoty Tf. V predchádzajúcej rovnici sa tiež javí cp, čo je špecifické teplo materiálu pri konštantnom tlaku, pretože proces sa vykonal týmto spôsobom.
Všimnite si, že citlivé teplo je pozitívne, keď je absorbované objektom a spôsobuje zvýšenie teploty.
V prípade, že sa dodáva plyn uzavretý v tuhej nádobe, proces bude izokorický, to znamená pri konštantnom objeme; A citlivý vzorec tepla bude napísaný takto:
Môže vám slúžiť: zvlnený pohyb: charakteristiky, typy vĺn, príkladyQ = Cvložka. m . (TF - TónJo)
Adiabatický koeficient γ
Pomer medzi špecifickým teplom pri konštantnom tlaku a špecifickým teplom pri konštantnom objeme pre ten istý materiál alebo látka sa nazýva Adiabatický koeficient, ktorý sa všeobecne označuje pomocou listu gama gama gama.
On Adiabatický koeficient je väčší ako jednotka. Teplo potrebné na zvýšenie teploty tela gramu hmotnosti do triedy je väčšie v izobarickom procese ako v izocioroch.
Je to tak preto, že v prvom prípade sa časť tepla používa na vykonávanie mechanickej práce.
Okrem špecifického tepla sa zvyčajne definuje tepelná kapacita tela. Toto je množstvo tepla potrebného na zvýšenie teploty tohto tela ako stupeň centigradu.
Tepelná kapacita c
Tepelná kapacita je označená C veľké písmená, zatiaľ čo špecifické teplo s c malými písmenami. Vzťah medzi oboma sumami je:
C = c⋅ m
Kde m Je to hmotnosť tela.
Používa sa tiež molárne teplo, ktoré je definované ako množstvo citlivého tepla potrebného na zvýšenie teploty Celzia alebo Kelvin.
Špecifické teplo v tuhých látkach, kvapalinách a plynoch
Špecifické molárne teplo väčšiny tuhých látok má hodnotu blízko 3 časy R, kde R Je to univerzálna konštanta plynov. R = 8,314472 J/(mol ℃).
Napríklad hliník má špecifické molárne teplo 24,2 j/(mol ℃), Meď 24,5 J/(mol ℃), zlato 25,4 J/(mol ℃), A sladké železo 25,1 J/(mol ℃). Všimnite si, že tieto hodnoty sú blízko 3R = 24,9 J/(mol ℃).
Na druhej strane, pre väčšinu plynov je špecifické teplo blízko N (r/2), kde je n Celé číslo a R Je to univerzálna konštanta plynov. Celé číslo n súvisí s počtom stupňov voľnosti molekuly, ktorá tvorí plyn.
Napríklad v ideálnom monookomickom plyne, ktorého molekula má iba tri stupne voľnosti, je špecifické molárne teplo na konštantný objem 3 (r/2). Ale ak je to ideálny diatomický plyn, sú navyše dva stupne rotácie, tak cvložka = 5 (r/2).
Môže vám slúžiť: polkruh: Ako vypočítať obvod, oblasť, centroid, cvičeniaV ideálnych plynoch sa splní nasledujúci vzťah medzi špecifickým tepelným molárnym teplom a konštantným objemom: cp = cvložka + R.
Bočná zmienka si zaslúži vodu. V kvapalnom stave pri 25 ℃ voda má cp = 4,1813 J/(G ℃), Vodná para pri 100 stupňov Celzia má cp = 2 080 j/(g ℃) A vodný ľad až do nulovej triedy Celzia má cp = 2 050 J/(G ℃).
Rozdiel s latentným teplom
Hmota sa nachádza v troch štátoch: pevná, tekutina a plynná. Na zmenu stavu je potrebná energia, ale každá látka na ňu reaguje iným spôsobom podľa jeho molekulárnych a atómových charakteristík.
Keď sa tuhá látka rozparí alebo sa kvapalina odparuje, teplota objektu zostáva konštantná, až kým všetky častice nezmenia svoj stav.
Preto je možné, že jedna látka je súčasne v rovnováhe v dvoch fázach: tuhá látka - kvapalina alebo kvapalina - napríklad para. Množstvo látky môže prejsť z jedného stavu do druhého pridaním alebo odstránením trochu tepla, zatiaľ čo teplota zostáva pevná.
Teplo dodávané do materiálu spôsobuje, že jeho častice budú refultované a zvýšenie jeho kinetickej energie. To sa premieta do zvýšenia teploty.
Je možné, že energia, ktorú získajú, je taká veľká, že sa už nevracia do svojej rovnovážnej polohy a zvyšuje oddelenie medzi nimi. Keď k tomu dôjde, teplota sa nezvyšuje, ale látka prechádza z pevnej látky na kvapalinu alebo plynnú tekutinu.
V teple potrebnom, aby sa to stalo, je známy ako latentné teplo. Preto je latentné teplo teplo, pomocou ktorého môže látka zmeniť fázu.
Tu je rozdiel s citlivým teplom. Látka, ktorá absorbuje citlivé teplo, zvyšuje jeho teplotu a zostáva v rovnakom stave.
Ako vypočítať latentné teplo?
Latentné teplo sa vypočíta na rovnicu:
Q = m . L
Kde L Môže to byť špecifické teplo odparovania alebo fúzie. Jednotky L Sú energia/hmotnosť.
Vedci dali početné denominácie tepla v závislosti od typu reakcie, v ktorej sa zúčastňuje. Napríklad existuje teplo reakcie, teplo spaľovania, teplo solidácie, teplo roztoku, teplo sublimácie a mnoho ďalších.
Môže vám slúžiť: Kinetická energia: Charakteristiky, typy, príklady, cvičeniaHodnoty mnohých z týchto typov tepla pre rôzne látky sú uvedené do tabuľky.
Vyriešené cvičenia
Príklad 1
Predpokladajme, že má 3 kg hmotnostného hliníka. Spočiatku je pri 20 ° C a chcete zvýšiť svoju teplotu až do 100 ° C. Vypočítajte potrebné citlivé teplo.
Riešenie
Najprv potrebujeme poznať konkrétne teplo hliníka
cp = 0,897 J / (g ° C)
Takže množstvo tepla potrebného na zahriatie kusu hliníka bude
Q = Cp m (tf - ti) = 0,897 * 3000 * (100 - 20) j
Q = 215280 j
Príklad 2
Vypočítajte množstvo tepla potrebného na zahriatie 1 litra vody z 25 ° C na 100 ° C na hladine mora. Vyjadrite výsledok aj v kilokalóriách.
Riešenie
Prvá vec, ktorú by sme si mali pamätať, je, že 1 liter vody váži 1 kg, to je 1 000 gramov.
Q = Cp m (tf - ti) = 4,1813 j/(g ℃) * 1000 g * (100 ℃ - 25 ℃) = 313597,5 j
Kalória je jednotka energie, ktorá je definovaná ako citlivé teplo potrebné na zdvihnutie gramu vody na Celzia. Preto 1 kalória zodpovedá 4 1813 joules.
Q = 313597,5 j * (1 cal / 4,1813 j) = 75 000 vápna = 75 kcal.
Príklad 3
Kus materiálu 360,16 gramov sa zahrieva z 37 ℃ do 140 ℃. Dodávaná tepelná energia je 1150 kalórií.
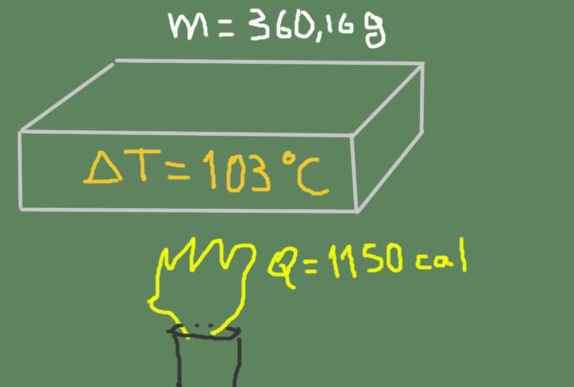 Zahrievanie vzorky. Zdroj: Self Made.
Zahrievanie vzorky. Zdroj: Self Made. Nájdite špecifické teplo materiálu.
Riešenie
Podľa vzorca môžeme napísať špecifické teplo na základe citlivej variácie tepla, hmotnosti a teploty:
cp = Q /(m Δt)
Nahradenie údajov, ktoré máme:
cp = 1150 cal / (360,16 g * (140 ℃ - 37 ℃)) = 0.0310 Cal / (G ℃)
Ale ako kalória zodpovedá 4 1813 j, výsledok sa dá vyjadriť aj ako
cp = 0,130 j / (g ℃)
Odkazy
- Giancoli, D. 2006. Fyzika: Princípy s aplikáciami. 6th. Edimatizovať. Sála. 400 - 410.
- Kirkpatrick, L. 2007. Fyzika: pohľad na svet. 6ubytovať sa Skrátene vydanie. Učenie sa. 156 - 164.
- Tippens, P. 2011. Fyzika: Koncepty a aplikácie. 7. Revidované vydanie. McGraw Hill. 350 - 368.
- Rex, a. 2011. Základy fyziky. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Fyzika univerzity s modernou fyzikou. 14th. Objem1. 556 - 553.
- Serway, r., Vulle, C. 2011. Základy fyziky. 9nat Učenie sa. 362 - 374.
- « Charakteristiky troponínu, štruktúra, funkcie a testy
- Ceped Tepelné vzorce, ako ich vypočítať a vyriešené cvičenia »

