Ceped Tepelné vzorce, ako ich vypočítať a vyriešené cvičenia

- 2937
- 429
- Ing. Ervín Petruška
On Prevedené teplo Je to prenos energie medzi dvoma telami pri rôznych teplotách. Ten, ktorý je vyššia teplota, dáva teplo, ktorej teplota je nižšia. Či už telo poskytuje alebo absorbuje teplo, jeho teplota alebo jeho fyzický stav sa môže líšiť v závislosti od hmotnosti a charakteristík materiálu, ktorého sa vyrába.
Dobrým príkladom je šálka naparovania kávy. Lyžica kovu, s ktorou sa mieša cukor. Ak zostane vo vnútri šálky dostatok času, káva a kovová čajová lyžička sa skončí. Určité teplo prejde do životného prostredia, pretože systém nie je izolovaný.
 Káva a čajová lyžička sa na chvíľu stanú v tepelnej rovnováhe. Zdroj: Pixabay.
Káva a čajová lyžička sa na chvíľu stanú v tepelnej rovnováhe. Zdroj: Pixabay. Keď sú teploty zhodné, tepelná rovnováha.
Keby sa ten istý test vykonal s plastovou čajovou lyžičkou, určite by si všimla, že sa neohrieva tak rýchlo ako kov, ale nakoniec sa stane v rovnováhe s kávou a všetko, čo ju obklopuje.
Je to preto, že kov vedie teplo lepšie ako plast. Na druhej strane, káva určite dáva teplo inou rýchlosťou ako horúca čokoláda alebo iný nápoj. Potom teplo priradené alebo absorbované každým objektom závisí od toho, ktorý materiál alebo látka sa vyrába.
[TOC]
Čo je a vzorce
Teplo sa vždy týka prietoku alebo tranzitu energie medzi jedným objektom a druhým, kvôli teplotnému rozdielu.
Preto sa hovorí o teple priradenom alebo absorbovanom teple, pretože nejakým spôsobom pridaním alebo extrahovaním tepla alebo energie je možné modifikovať teplotu prvku.
Zvyčajne sa nazýva množstvo tepla, ktoré poskytuje najteplejší objekt. Táto hodnota je úmerná hmotnosti uvedeného objektu. Telo s veľkou hmotnosťou je schopné vzdať sa viac tepla ako iná z menšej hmoty.
Môže vám slúžiť: Millikan Experiment: Postup, vysvetlenie, dôležitosťTeplotný rozdiel Δt
Ďalším dôležitým faktorom pri výpočte priradeného tepla je teplotný rozdiel, ktorý objekt, ktorý poskytuje tepelné, prežíva. Je označený ako δTón A je to takto:
Δt = tF - Tónani
Nakoniec, množstvo priradeného tepla závisí aj od povahy a charakteristík objektu, ktoré sú zhrnuté kvantitatívne v konštante nazývanej Špecifické teplo teploty, označený ako c.
Nakoniec výraz priradeného tepla je nasledujúci:
OtázkaZasadiaci = - m.c.ΔTón
Výťažok je symbolizovaný negatívnym znakom.
Špecifická kapacita tepla a tepelnej kapacity látky
Špecifické teplo je množstvo tepla potrebného na zvýšenie teploty 1 g látky o 1 ° C. Je to vnútorná vlastnosť materiálu. Jej jednotky v medzinárodnom systéme sú: joule/kg . K (Joule medzi kilogramom x teplota v stupňoch Kelvin).
Tepelná kapacita C je prepojená, ale mierne odlišná koncepcia, pretože hmotnosť objektu zasahuje. Tepelná kapacita je definovaná takto:
C = MC
Jeho jednotky v S.Jo. Sú joule/k. Aby sa ceded teplo mohlo tiež vyjadriť rovnocenne ako:
Q = -C. ΔTón
Ako ho vypočítať?
Na výpočet tepla priradeného objektom je potrebné poznať nasledujúce:
- Špecifické teplo látky, ktorá dáva teplo.
- Hmotnosť uvedenej látky
- Konečná teplota na získanie
Špecifické tepelné hodnoty pre mnoho materiálov boli stanovené experimentálne a sú k dispozícii v tabuľkách.
Kalorimetria
Teraz, ak táto hodnota nie je známa, je možné ju získať pomocou teplomeru a vody v tepelne izolovanej nádobe: kalorimeter. Schéma tohto zariadenia je uvedená na obrázku, ktorý sprevádza cvičenie 1.
Vzorka látky je ponorená pri určitej teplote v množstve vody, ktorá sa predtým merala. Meria sa konečná teplota a pri získaných hodnotách sa určuje špecifické teplo materiálu.
Môže vám slúžiť: náhodná chyba: vzorec a rovnice, výpočet, príklady, cvičeniaPri porovnaní výsledku s tabuľkovými hodnotami je známe, o akú látku to je. Tento postup sa volá kalorimetria.
Tepelná bilancia sa vykonáva zachovaním energie:
Otázka Zasadiaci + Otázka absorbované = 0
Vyriešené cvičenia
Cvičenie 1
0 kus 0.35 kg pri teplote 150 ° C v 500 ml vody pri teplote 25 ° C. Nájsť:
a) konečná rovnovážna teplota
b) Koľko tepelných tokov v tomto procese?
Údaje
cmeď = 385 j/kg . ° C
cvoda = 4180 j/kg . ° C
Hustota vody: 1000 kg/m3
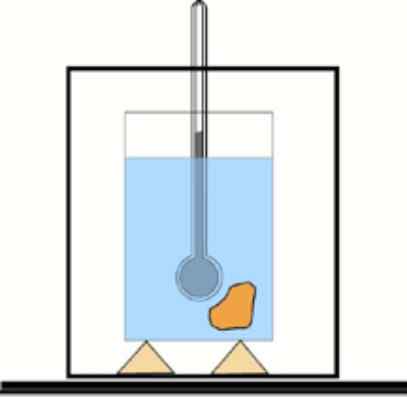 Základná schéma kalorimetra: nádoba s izolovanou vodou a teplomer na meranie zmien teploty. Lfiente: Dr. Tilahun Tesfaye [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Základná schéma kalorimetra: nádoba s izolovanou vodou a teplomer na meranie zmien teploty. Lfiente: Dr. Tilahun Tesfaye [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Riešenie
a) Meď dáva teplo, zatiaľ čo voda ju absorbuje. Keďže sa systém považuje za uzavretý, v tepelnej bilancii zasahujú iba voda a vzorka:
Otázka Zasadiaci = Q pohltený
Na druhej strane je potrebné vypočítať hmotnosť 500 ml vody:
500 ml = 0.5 l = 0.0005 m3
S týmito údajmi sa vypočíta hmotnosť vody:
hmotnosť = hustota x objem = 1 000 kg/m3 . 0.0005 m3 = 0.5 kg
V každej látke sa zvyšuje tepelná rovnica:
OtázkaZasadiaci = -mmeď . cmeď. ΔT = -0.35 kg . 385 j/kg .° C . (TF -150 ° C) = -134.75 (tF - 150) J
Otázkapohltený = mvodná voda . cvodná voda. ΔT = 0.5 kg . 4186 j/kg . ° C .(TF -25 ° C) = 2093 (tF -25) J
Vyrovnať výsledky, ktoré máte:
2093 (tF - 25) = -134.75 (tF - 150)
Je to lineárna rovnica s neznámym, ktorého riešenie je:
TónF = 32.56 ° C
b) Množstvo tepelného tepla je priradené teplo alebo absorbované teplo:
Otázka Zasadiaci = - 134.75 (32.56 - 150) j = 15823 j
Otázka pohltený = 2093 (32.56 - 25) j = 15823 j
Cvičenie 2
100 g medený kus sa zahrieva v rúre na teplotu Tani A potom sa zavedie do medi kalorimeter 15 g, ktorý obsahuje 200 g vody pri 16 ° C. Konečná teplota raz v rovnováhe je 38 ° C. Keď sa zváži kalorimeter a jeho obsah, zistí sa, že 1 sa odparil.2 g vody Aká bola počiatočná teplota tani?
Môže vám slúžiť: Červohra: História, teória, typy, formovanieÚdaje: latentné teplo vodnej odparovania je lvložka = 2257 kj/kg
Riešenie
Toto cvičenie sa líši od predchádzajúceho, pretože sa treba uvažovať o tom, že kalorimeter tiež absorbuje teplo. Teplo priradené kusom medi je investované do všetkých nasledujúcich možností:
- Zohrejte vodu z kalorimetra (200 g)
- Zohrejte meď, ktorého kalorimeter je vyrobený (150 g)
- Odpariť 1.2 gramy vody (pre fázovú zmenu potrebujete aj energiu).
OtázkaZasadiaci = -100 X 1 x 10 -3 kg. 385 j/kg . ° C. (38 - tani ) ° C = -38.5. (38 - tani) J
Otázka pohltený ním kalorimeter = Q absorbovaný vodou + Otázka odparovanie + Otázka absorbovaný meďou
0.2 kg .4186 j/kg ° C .(38 - 16 ° C) + 1.2 x 10-3 kg. 2257000 j/kg +0.150 kg .385 j/kg .° C.(38 - 16 ° C) =
18418.4 +2708.4 + 1270.5 J = 22397.3 j
Preto:
-38.5. (38 - tani) = 22397.3
Tónani = 619.7 ° C
Mohlo by sa zvážiť aj teplo potrebné na prepravu 1.2 g vody do 100 ° C, ale v porovnaní je pomerne malé množstvo.
Odkazy
- Giancoli, D. 2006. Fyzika: Princípy s aplikáciami. 6th. Edimatizovať. Sála. 400 - 410.
- Kirkpatrick, L. 2007. Fyzika: pohľad na svet. 6ubytovať sa Skrátene vydanie. Učenie sa. 156 - 164.
- Rex, a. 2011. Základy fyziky. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Fyzika univerzity s modernou fyzikou. 14th. Edimatizovať. Zväzok 1. 556 - 553.
- Serway, r., Vulle, C. 2011. Základy fyziky. 9nat Učenie sa.

