Latentné teplo
- 3891
- 798
- Blažej Hrmo
Čo je latentné teplo?
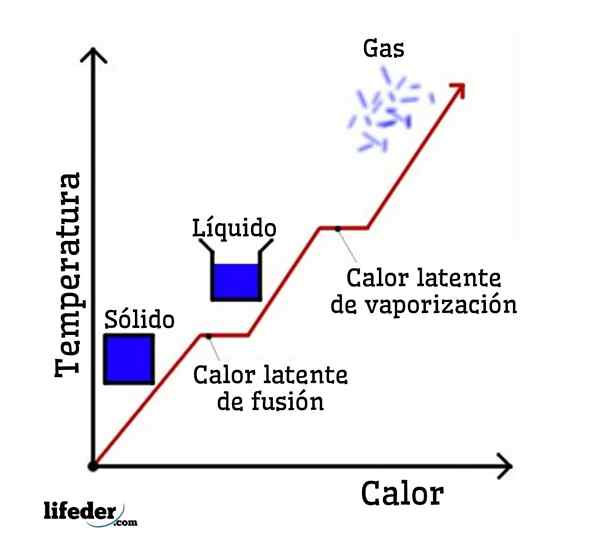
Latentné teplo je množstvo tepla, ktoré musí absorbovať alebo oddeliť látku, aby sa zmenila fyzický stav alebo fáza, čím sa udržiava konštantná teplota počas tohto procesu. Dodávané alebo uvoľnené teplo sa nepreukazuje, v teplotnej variácii sa „necíti“ ako obvykle; Preto termín latentného tepla.
Latentné slovo pochádza z latinského slova „latenns“, čo znamená skryté, takže latentné teplo sa správa, akoby neexistovala, keď je teplota konštantná. Ale existuje: Čo sa stane, je to, že sa úplne spotrebuje pri zmene fázy alebo fyzického stavu.
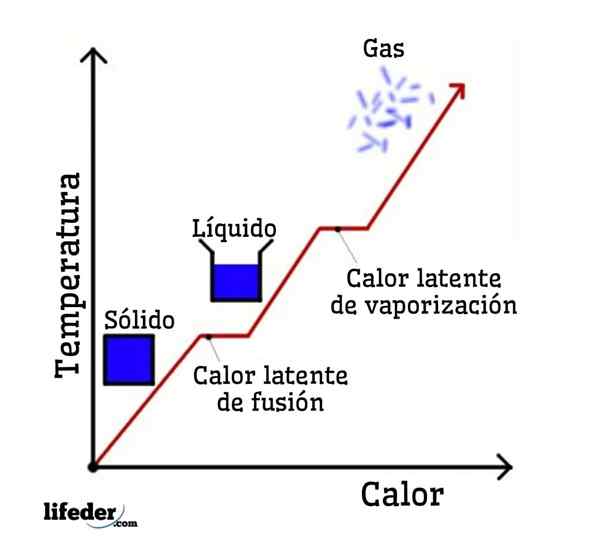
Ak sa ako príklad odoberie voda, fázové zmeny sú nasledujúce: ľad (tuhý) topí na kvapalnú (kvapalnú) vodu v procese nazývanom fúzia; a kvapalná voda sa následne odparuje, aby sa transformovala na vodnú paru (plyn) na proces nazývaný odparovanie.
Na druhej strane sa vodná para ochladí na kvapalnú vodu v procese nazývanom kondenzácia; a tekutá voda sa v procese nazývaného tuhosť opäť stáva ľadom.
Každá z týchto fázových zmien má spojené latentné teplo, ktoré môže byť pozitívne (absorpcia) alebo negatívne (uvoľnenie).
Latentné topiace teplo
 Zmena z pevnej na tekutinu; fúzia
Zmena z pevnej na tekutinu; fúzia Je to množstvo tepla, ktoré sa musí dodávať do určitého množstva tuhej látky, aby sa zmenila jej fyzická podmienka z pevnej na kvapalnosti. Počas fúzie nedochádza k žiadnej zmene teploty, takže zatiaľ čo tuhá látka je založená alebo roztavte kvapalinu, ktorá sa z nej generuje, má rovnakú teplotu ako celá tuhá látka.
Všeobecne sa toto teplo určuje v normálnom fúznom bode, čo je teplota, pri ktorej sa tuhá látka začína zlúčiť pod atmosférickým tlakom. Pri tejto teplote je súčasná rovnováha alebo prítomnosť v rovnakom období tuhého stavu a kvapalného stavu.
Môže vám slúžiť: kategorická premenná: Charakteristiky a príkladyPevný stav sa vyznačuje prítomnosťou kompaktnej štruktúry v dôsledku existencie veľkých chemických väzieb, ktoré mu dodávajú štrukturálnu tuhosť. Na transformáciu tuhej látky na kvapalinu sa tieto interakcie musia rozbiť, takže sa na tento účel spotrebuje (absorbuje) energiu.
Typickým príkladom je, keď sa konzumuje zmrzlina, tvorená vodou, cukrom a inými látkami. Je bežné poznamenať, že zmrzlina, ak sa rýchlo nespotrebuje, sa začne topiť, to znamená, že sa topí. K tomu dochádza, keď teplota zmrzliny dosiahne bod topenia ľadu.
Príklady
Uvádzajú sa uvedené príklady latentných fúznych ohrievaní vyjadrených v J/G; To znamená, že energia, ktorú musí gram tuhej látky pohltiť, aby sa topil v bode topenia:
-Ľad 334.0
-380 hliník.0
-Síra 38.1
-Meď 134.0
-Etanol 104.0
-Ortuť 11.8
-Zlato 64.5
-Striebro 80.3
-Olovo 24.5
-Volfrám 184
Ice absorbuje veľmi teplo nie preto, že jeho interakcie sú silnejšie, ale preto, že je schopný mimoriadne rozptýliť teplo medzi jeho kryštálmi.
Latentné teplo odparovania
Je to množstvo tepla, ktoré absorbuje určité množstvo látky, aby sa presunulo z kvapalného stavu do plynného stavu v normálnom bode varu. To znamená, že tekutina sa absorbuje, keď sa varí a stáva sa plyn bez zvýšenia teploty.
V lone tekutiny môžu molekuly látok interagovať s tvorbou vodíkových mostov a pre príťažlivé sily medzi molekulami. Aby ste prešli látkou z kvapalného stavu do plynného stavu, musíte tieto sily prekonať, takže musíte dodať teplo.
Citlivé teplo sa stáva tým, ktoré absorbuje kvapalinu iba na zvýšenie jej teploty, ktorá bude závisieť od jej špecifického tepla. Medzitým sa latentné teplo odparovania používa na jeho transformáciu priamo do pary, čo je proces, ktorý je oveľa jednoduchší v bode varu.
Môže vám slúžiť: Kalibračná krivka: Na čo je to, ako to urobiť, príkladyPríklady
Nižšie sú uvedené príklady niektorých tekutín s ich príslušnými latentnými zahrievaním odparovania vyjadrených opäť v J/G:
-Kyselina octová 402
-Acetón 518
-Voda 2256
-Etylalkohol 846
-Síra 1510
-Benzén 390
-Oxid uhličitý 574
-Chlór 293
-Éter 377
-Glycerín 974
-Ortuť 295
-Kyslík 214
Všimnite si obrovské latentné teplo kvapalnej vody: 1 g kvapalnej vody (asi 1 ml) musí absorbovať 2256 J na odparovanie. Kvapalná voda stále rozptyľuje teplo, ktoré dostáva oveľa lepšie v porovnaní s ľadom.
Latentné tuhé teplo
Je to teplo, ktoré musí oddeliť určité množstvo látky, aby sa presunulo z tekutého stavu do svojho tuhého stavu v mieste tuhnutia alebo zmrazenia. Opäť, kým kvapalina nezastavená, teplota zostane konštantná.
Proces tuhnutia je inverzný na proces fúzie, takže hodnoty latentného tepla tuhnutia a hodnôt latentného tepla fúzie sú rovnaké, ale s opačnými príznakmi.
Molekuly látky v kvapalnom štáte sa pohybujú s určitou voľnosťou kvôli energii, ktorú majú. Preto, aby sa presunuli do tuhej fázy, musia molekuly uvoľňovať energiu vo forme tepla, čo umožňuje väčšiu interakciu medzi molekulami látky.
Interakcia medzi molekulami uprednostňuje tvorbu chemických väzieb tuhej fázy. Príklad toho nastane, keď sa kvapalná voda umiestni do nádob na tvorbu ľadu v chladničke chladničky. Výťažky z mrazničky zahrievajú z kvapalnej vody a stuhnite sa, aby sa stal ľadom.
Príklady
Nižšie sú uvedené niektoré príklady latentných tuhých látok (v j/g) pre niektoré tekutiny:
Môže vám slúžiť: Biela diera: História, teória a ako sa formuje-Voda (-334)
-Hliník (-380)
-Síra (-38)
-Meď (-134)
-Etanol (-104)
Latentné kondenzačné teplo
Je to množstvo tepla, ktoré sa musí uvoľniť alebo uvoľniť z určitého množstva látky, aby sa presunul z plynu do tekutého stavu. Plyn, ktorý je kondenzovaný a vytvorená kvapalina si zachováva rovnakú teplotu počas kondenzácie.
Kondenzácia je proces v rozpore so odparovaním. Latentné kondenzačné teplo má rovnakú hodnotu ako latentné teplo odparovania, ale s opačným znakom a v bode varu. Príkladom toho je, keď sa varí a para sa kondenzuje vo vnútornej strane hrncov.
Plynné molekuly sa pohybujú voľne poháňané energiou, ktorú majú. Preto musia uvoľniť energiu, aby sa umožnilo ustanovenie intermolekulárnych interakcií kvapalného stavu medzi molekulami látky.
V prírode existuje mnoho ďalších príkladov javu kondenzácie vody. Vodná pár vystúpi v atmosfére a kondenzuje v oblakoch vo forme kvapiek vody.
V pohári automobilov je tiež prítomnosť kvapôčok vody, čo je produkt kondenzácie vody v dôsledku zníženia teploty v skorých rána, čo predstavuje So -Called Rocío.
Príklady
Nakoniec, ich príslušné latentné kondenzačné ohrievy vyjadrené znova, v J/G: budú uvedené pre niektoré výpary:
-Kyselina octová (-402)
-Acetón (-518)
-Voda (-2256)
-Etylalkohol (-846)
-Síra (-1510)
-Benzén (-390)
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Walter J. Moore. (1963). Fyzikálna chémia. V chemickej kinetike. Štvrté vydanie, Longmans.
- Wikipedia. (2020). Latentné teplo. Zdroj: In.Wikipedia.orgán
- Redaktori Enyclopaedia Britannica. (2020). Latentné teplo. Získané z: Britannica.com
- Inžiniersky. (2003). Tekutiny: latentné teplo odparovania. Zdroj: Engineeringtoolbox.com
- Učenie lúmenu. (s.F.). Fázová zmena a dané teplo. Uzdravené z: kurzov.Lumenarning.com

