Vyváženie chemických rovníc
- 4934
- 859
- Václav Višňovský
Aké je vyváženie chemických rovníc?
Vyváženie chemických rovníc je matematická operácia, ktorá sa vykonáva na udržanie zákona o zachovaní hmoty v reakciách. Hmota nie je vytvorená ani zničená. Preto musí byť počet atómov pred a po chemickej reakcii rovnaký, a to tak v reagenciách aj v produktoch.
Ak chcete vyvážiť chemickú rovnicu, musíte spočítať atómy pred a po šípke. Ak sa čísla zhodujú, znamená to, že reakcia je vyvážená. V opačnom prípade bude potrebné porovnať tieto čísla úpravou stechiometrických koeficientov pokusom a omylom, čo je najjednoduchšia a najintuitívnejšia metóda rovnováhy.
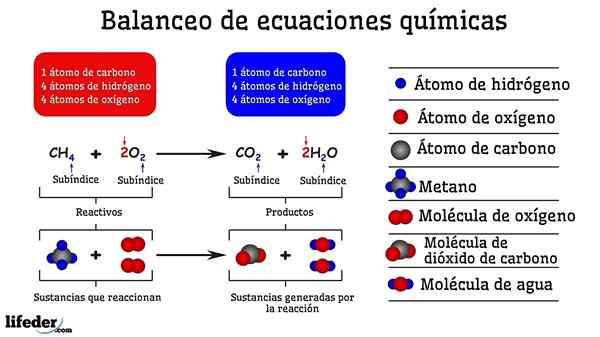
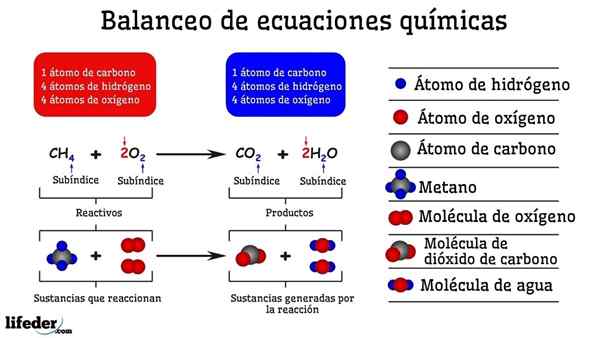 Príklad chemického vyváženia reakcie medzi metánom a dvoma molekulami kyslíka
Príklad chemického vyváženia reakcie medzi metánom a dvoma molekulami kyslíka Ak je vyvážená pokusom a omylom, akoby boli odstránené alebo pridané atómy v jednej z dvoch strán subbaja. Kým Subbaja nie je vodorovne zavesený, chemická rovnica nebude úplne vyvážená. Na akýchkoľvek stranách nemôže existovať viac (vytvorenie hmoty) alebo menej atómov (zničte hmotu).
Ľahké vyváženie príkladov rovníc
V nasledujúcich príkladoch uvidíte vyvážené alebo ľahko vyvážené chemické rovnice. Všetko musí mať spoločné, že počet atómov pre každý z prvkov bude rovnaký pred a po šírení, keď bude chemická rovnica vyvážená.
Oxidácia ortuti
2hg +o2 → Hg2Ani2
Máme dva prvky: ortuť (HG) a kyslík (O). Vyjadrime počet ich atómov pred (reagenciami) a potom (produkty) šípky:
HG: 2 (vľavo) - 2 (vpravo)
Môže vám slúžiť: Molárna frakcia: Ako sa vypočítava, príklady, cvičeniaO: 2 (vľavo) - 2 (vpravo)
Rovnica je vyvážená, pretože atómy Hg a alebo sú rovnaké na oboch stranách šípky.
Spaľovanie vodíka
H2 + Ani2 → H2Ani
Máme opäť dva prvky: vodík (H) a kyslík (O). Opakovanie predchádzajúceho kroku:
H: 2 - 2
O: 2 - 1
Na ľavej strane je kyslík viac ako vpravo. Preto musíme pridať ďalší pravý kyslík. Aby sme to dosiahli, upravujeme stechiometrické koeficienty, ktoré sú číslami, ktoré sprevádzajú a predchádzajú vzorcom. Ak umiestnime 2 pred H2Alebo nám dá:
H2 + Ani2 → 2h2Ani
H: 2 - 4
O: 2 - 2
Kyslík je vyvážený. Ale nie vodídle. Teraz musíte doľava pridať dva hydrogény:
2h2 + Ani2 → 2h2Ani
H: 4 - 4
O: 2 - 2
A rovnica je konečne vyvážená: Rovnaký počet H a alebo pred a po šípke.
Všimnite si, že stechiometrické koeficienty (2 pre h2 a 1 pre O2) vynásobte predplatné vzorcov. Toto násobenie nám poskytne celkový počet atómov pre konkrétny prvok.
Zníženie horčíka
Mg (nie3)2 + 2LI → mg +2lino3
Hodnotíme čísla atómov pre každý prvok:
Mg: 1 - 1
Li: 2 - 2
N: 2 - 2
O: 6 - 6
Chemická rovnica je už vyvážená a nie je potrebné ju vyvážiť.
Vyriešené cvičenia
Predtým, ako budete vyvážiť akúkoľvek rovnicu, je vždy potrebné potvrdiť, či už nie je vyvážená. To znamená, že pokračujeme v nasledujúcom cvičení:
Cvičenie 1
Vyvážený alebo nie?
Vernosť2Ani3 + H2O → viera (oh)3
Máme tri prvky: železo (viera), vodík a kyslík. Návrh v čase rovnovážnych rovníc je začať počítať čísla atómov menej hojného prvku v rovnici; ktoré sa zvyčajne líšia od H a O. Preto najprv počítame atómy viery:
Môže vám slúžiť: metyl salicylátViera: 2 - 1
Index 3 z (OH)3 Neznásobujte vieru vľavo. Pre H a O máme:
H: 2 - 3
O: 4 - 3
Všetky prvky sú nevyvážené.
Výkyvný
Pred rovnovážou H a O musíme vyvážiť atómy viery: najmenej hojný prvok, pretože na rozdiel od 5 hodín a 7 alebo 7 alebo 7 alebo 7 je takmer 3 viera, na rozdiel od 5 hodín a 7 alebo 7. Musíte teda pridať vieru napravo:
Viera: 2 - 2
Čo sa rovná tomu, aby pred Viera (oh) umiestnil 2 ako stechiometrický koeficient (OH)3. Rovnica zostane:
Vernosť2Ani3 + H2O → 2Fe (OH)3
Viera: 2 - 2
H: 2 - 6
O: 4 - 6
Ale h a o alebo pokračujte nevyvážené. H2Alebo prispievať 2 hodiny a chýba nám 4 hodiny. Preto pridáme ďalšie dve h2Alebo pre nás, aby sme mali tri h2Buď:
Vernosť2Ani3 + 3h2O → 2Fe (OH)3
A znova hodnotíme:
Viera: 2 - 2
H: 6 - 6
O: 6 - 6
Všimnite si, ako ich vyvažovali, keď sme raz vyvážili H. Rovnica je konečne vyvážená.
Cvičenie 2
Vyvážený alebo nie?
Chvály4 + Ani2 → CO2 + H2Ani
Hodnotíme počet atómov pre všetky súčasné prvky:
C: 1 - 1
H: 4 - 2
O: 2 - 3
Uhlík je vyvážený, ale to isté sa nestane s vodíkom a kyslíkom. Rovnica je nevyvážená.
Výkyvný
Pretože C je vyvážený, nechceme modifikovať stechiometrické koeficienty CH4 alebo co2. Aspoň nie v zásade.
Zameriavame svoju pozornosť na H a O, najmä na H. Pretože? Pretože videnie rovnice je ľahšie vyvážiť H pred alebo. Musíme pridať 2 hodiny doprava a umiestniť koeficient 2 pred H2Buď:
Chvály4 + Ani2 → CO2 + 2h2Ani
C: 1 - 1
H: 4 - 4
O: 2 - 4
C a H sú vyvážené. Zostali sme 2 alebo vľavo. Ak každý alebo2 prispieva 2 alebo pridáme a alebo2 navyše, aby boli 4 alebo vľavo. To je rovnaké ako umiestnenie koeficientu 2 pred O2:
Môže vám slúžiť: oxid síryChvály4 + 22 → CO2 + 2h2Ani
C: 1 - 1
H: 4 - 4
O: 4 - 4
A rovnica je konečne vyvážená.
Cvičenie 3
Vyvážený alebo nie?
N2 + H2 → NH3
Hodnotíme pre naše dva prvky n a h:
N: 2 - 1
H: 2 - 3
Rovnica nie je vyvážená.
Výkyvný
Začneme vyvážiť n, prvok odlišný od h. Chýba nám právo a rovnako ako každý NH3 prispieva 1 n, musíme pridať ďalší NH3 Mať 2 n:
N2 + H2 → 2nh3
N: 2 - 2
H: 2 - 6
A teraz nám chýba ľavica. Ak každý h2 Prispejte 2 hodiny k rovnici, potom musíme pridať ďalšie dve, aby ich bolo 6 h. Je to rovnaké ako umiestnenie stechiometrického koeficientu 3 pred H2:
N2 + 3h2 → 2nh3
N: 2 - 2
H: 6 - 6
A chemická rovnica je konečne vyvážená.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Chémia librettexts. (23. novembra 2020). Ako písať vyvážené chemické rovnice. Získané z: Chem.Librettexts.orgán
- Wikipedia. (2020). Chemická rovnica. Zdroj: In.Wikipedia.orgán
- Princípy chémie. (s.F.). Písanie a vyváženie chemických rovníc. [PDF]. Zdroj: Web.Uviaznuť.Edu
- Phet. (s.F.). Vyváženie chemických rovníc. Získané z: Phet.Colorado.Edu
- Armando Marín B. (s.F.). Všeobecná chémia: Vyváženie rovníc. [PDF]. Získané z: Depa.Frame.Žobrák.mx

