Spaľovacie teplo

- 803
- 178
- Alfréd Blaho
Aké je teplo spaľovania?
On Spaľovacie teplo Je to energia uvoľnená, keď určité množstvo materiálu, zvyčajne jeden mol, reaguje exotermicky s kyslíkom vzduchu. Je to nevyhnutná termochémia pri charakterizácii palív, alkoholov a najmä uhľovodíkov, ako je bután a metán.
Keď látka spaľuje svetlo a teplo, energia, ktorá sa dá použiť na prácu na iných telách. Napríklad generované teplo je schopné zahrievať veľké objemy vody, ktorých parou tlačí okolie a pôsobí niektorými elektrickými generátormi; Alebo jednoducho ďalšie zahrievanie dusených potravín.
 Teplo generované spaľovaním kuchynského plynu sa používa na zahrievanie kotle a potravín
Teplo generované spaľovaním kuchynského plynu sa používa na zahrievanie kotle a potravín Spaľovacie teplo sa líši medzi všetkými látkami, aj keď jeho chemická povaha je v podstate rovnaká. Táto variácia zodpovedá relatívnej stabilite, to znamená: čím nestabilnejšia je zlúčenina, tým väčšia je uvoľnená energia, reprezentovaná ako -AH. Negatívny symbol znamená, že teplo tečie von.
Rôzne hodnoty -Hh sa používajú na porovnanie relatívnej stability medzi rôznymi alkausmi a ich izomérmi. Tiež umožňuje, aby bol stabilný.
Meranie
Na meranie spaľovacích teplôt je potrebné kalorimetrické čerpadlo. V nej látka reaguje s kyslíkom aktiváciou elektrickej iskry.
Potom uvoľnené teplo zahrieva objem vody, ktorý obklopuje vzorkový priestor, meranie teploty pred a po spaľovaní, ako aj hmotnosť vody a paliva.
Uvoľnená energia sa teda bude rovnať:
Ceh2o·mH2Alebo · Δt
Kdeeh2o Je to špecifické teplo vody, 4.184 j/g · ° C, mH2Alebo hmotnosť vody a Δt jej zmena teploty. Nakoniec sa toto teplo, vyjadrené v jednotkách joule alebo kalórií, rozdelené medzi hmotnosť alebo krtómy paliva umiestneného vo vnútri kalorimetrického čerpadla, aby sa dosiahlo teplo spaľovania na jednotku hmoty alebo krtkov.
Môže vám slúžiť: aký je mechanický ekvivalent tepla?Kovy sa nekombinujú, ale oxidujú sa rôznymi rýchlosťami v závislosti od teploty, pri ktorej sú vystavené. Teplo, ktoré vyrábajú, je opovrhnutiahodné, aby sa meralo rovnakým spôsobom ako s uhľovodíkmi a inými palivami. Nie sú to preto horľavé látky.
Potenciálne energie
Počas spaľovania sú odkazy rozbité na vytvorenie nových, stabilnejšie. Energia obsiahnutá vo všetkých väzbách na molekuly je nezávislá od jej pohybu, takže existuje potenciálna energia.
Čím väčšia je potenciálna energia, tým bude molekula nestabilnejšia, a preto sa po vytvorení nových odkazov uvoľní viac tepla.
Ak chcete vedieť, ktoré presne tieto nové odkazy sú, mali by sa zvážiť výrobky úplného spaľovania: CO2 Pre uhlík, h2Alebo pre vodík a nie2 Pre dusík. Pokiaľ ide o uhľovodíky, ich úplné spaľovanie bude generovať stechiometrické zmesi CO2 a h2Ani.
Obe molekuly, co2 a h2Alebo majú veľmi nízke potenciálne energie, pretože ich odkazy (o = C = O a H-O-H) sú veľmi stabilné v porovnaní s uhľovodíkovými väzbami, z ktorých pochádzajú (C-H a C-C).
Relatívna stabilita
Potenciálne energie sú voľne. Ich variácie však nie sú, to znamená rozdiel týchto energií medzi výrobkami (CO2 a h2O) a reaktanty (uhľovodíky).
Z tohto dôvodu, prečo tieto variácie, alebo čo je rovnaké, ich spaľovacie ohrievate, môžete vedieť, aká je relatívna stabilita medzi sadou uhľovodíkov alebo izomérov.
Zatvoriť
Alkány môžu byť lineárne, rozvetvené alebo cyklické. V prípade lineárnych alkánov sa jeho teplo spaľovania líši v závislosti od dĺžky svojich reťazcov; to znamená, že záleží na tom, koľko jednotiek ch2 mať. Zvážte príklad n-hexán, n-heptano a n-oktán:
Môže vám slúžiť: jód: História, vlastnosti, štruktúra, získanie, riziká, použitieChvály3(Ch2)4Chvály3, -ΔH = 4163 kJ/mol
Chvály3(Ch2)5Chvály3, -ΔH = 4817 kJ/mol
Chvály3(Ch2)6Chvály3, -ΔH = 5471 kJ/mol
Vidíte, že jeho spaľovacie ohrievanie sa mení o 654 kJ/mol. To znamená, že každý Cho2 ktorý sa pridáva do reťazca, zvyšuje teplo spaľovania rýchlosťou 654 kJ/mol. Teda nonano, ch3(Ch2)7Chvály3, Bude mať spaľovacie teplo rovné 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol).
Je to rovnaké ako tvrdenie, že dlhšie reťazce majú väčšie potenciálne energie, a preto sú nestabilnejšie.
Ramified alkány sú stabilnejšie ako lineárne, a to sa odvodzuje z ich spaľovacích zahrievaní. Zvážte teraz prípad troch izomérov oktánu:
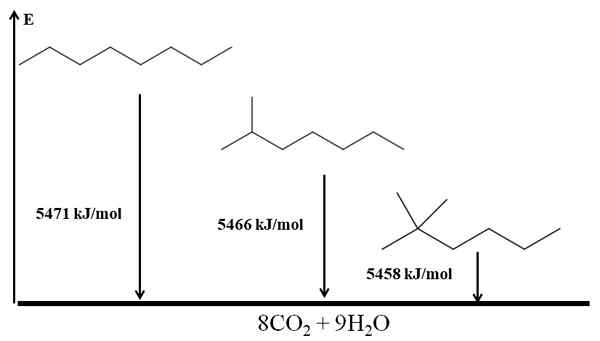 Spaľovanie sa zahrieva pre tri oktánové izoméry. Zdroj: Gabriel Bolívar cez Molview.
Spaľovanie sa zahrieva pre tri oktánové izoméry. Zdroj: Gabriel Bolívar cez Molview. On n-Octano je najstabilnejší, pretože jeho spaľovanie je najväčšie (5471 kJ/mol). Na druhej strane izoméry 2-metylheptano a 2,2-dimetylhexan. 2,2-dimetylhexan je najstabilnejší pre to, že je najviac rozvetvený z troch izomérov.
Alkény
Relatívna stabilita alkénov je možné získať aj zo svojich spaľovacích ohrievaní. Zoberme si napríklad štyri izoméry Butenus:
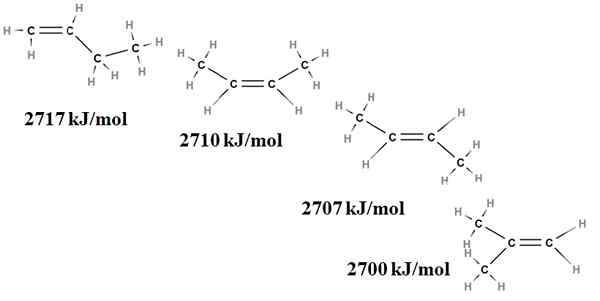 Spaľovanie sa zahrieva na izoméry buteno. Zdroj: Gabriel Bolívar cez Molview.
Spaľovanie sa zahrieva na izoméry buteno. Zdroj: Gabriel Bolívar cez Molview. Tu už nehovoríme o dôsledkoch, ale o stupni nahradenia dvojitého väzby, C = C a jeho napätia van der Waals; to znamená elektronických a stérických odporov medzi dvoma objemnými skupinami umiestnenými na tej istej strane dvojitého zväzku.
Prvý izomér, 1-butén, je najstabilnejší, pretože jeho dvojitá väzba je menej nahradená (h2C = c). To sa odráža v jeho spaľovacom teple 2717 kJ/mol.
Môže vám slúžiť: kyselina chlorogenováCis-2-butén je vpravo trochu stabilnejší, pretože jeho dvojitá väzba je nahradená viac. Ale trans-2-butén je ešte viac, pretože aj keď má rovnaký stupeň substitúcie, skupiny Choons3 dvojitej väzby je v trans -pozíciách, to znamená na rôznych stranách dvojitého zväzku. Všimnite si, že teplo Trans-2-buténu (2707 kJ/mol) je sotva o niečo nižšie ako v prípade cis-2-buténu (2710 kJ/mol).
Posledný izomér, 2-metyl-2-butén, ktorý je tiež rovnako nahradený ako cis a trans 2 bungeo, je napriek tomu najstabilnejší zo všetkých. Je to preto, že obaja ch3 Nachádzajú sa v jednom z uhlíkov dvojitého zväzku, a preto sú alkénové s Cho3 Geminále.
Zlúčeniny
Rovnako ako alkos a ďalšie uhľovodíky všeobecne, relatívna stabilita zlúčenín karbonylu (ketóny, aldehydy, karboxylové kyseliny) tiež súvisia so spaľovacími teplami.
Čím viac stabilizovaných alebo menej reaktívnych ich skupín c = o, budú maloleté svoje spaľovacie ohrevy.
Napríklad teplo spaľovania butána, ch3Chvály2Chvály2Cho, je to 2475 kJ/mol. Toto teplo je vyššie ako 2-butanón, ch3Chvály2Cocha3, čo sa rovná 2442 kJ/mol. Preto je butanal nestabilnejší ako 2-butanón.
V 2-butanone je C = o viac stabilizovaný vďaka skupinám ch3Chvály2 a Ch3; Vec, ktorá sa nestane s butánom, kde jedna zo skupín je sotva atóm h.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10. vydanie.). Wiley Plus.
- Wikipedia. (2020). Teplo spaľovania. Zdroj: In.Wikipedia.orgán
- Nadácia CK-12. Teplo spaľovania. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- BBC. (2020). Chemická energia: Entalpia spaľovania. Zdroj: BBC.co.Uk
- Steven a. Hardinger. (2017). Ilustrovaný glosár organickej chémie: Entalpia spaľovania. Získané z: Chem.UCLA.Edu

