Kalkogény alebo ampumos
- 2777
- 129
- Ing. Ervín Petruška
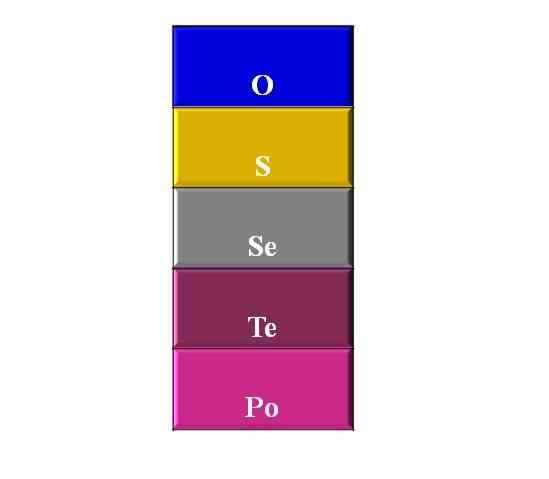
 Kalkogénne prvky. Zdroj: Gabriel Bolívar
Kalkogénne prvky. Zdroj: Gabriel Bolívar Čo sú kalkogény alebo ampumos?
Ten Kalgény ani Anfigenos Sú to chemické prvky, ktoré patria do skupiny alebo do kyslíkovej rodiny periodickej tabuľky. Nachádzajú sa v skupine cez alebo 16, umiestnené na pravej strane alebo blok P.
Hlava skupiny, ako už názov napovedá, je obsadený kyslíkovým prvkom, ktorý sa fyzikálny a chemicky líši od jej prvkov tej istej skupiny. Slovo „kalkogén“ odvodzuje z gréckeho slova Chalcos, Čo znamená meď.
Mnoho chemikálií označilo tieto prvky ako tréneri popola, kriedy, bronz a reťazí. Najúspešnejšia interpretácia však zodpovedá interpretácii „minerálnych formátorov“.
Kalkogény sa teda vyznačujú tým, že sú prítomné v nespočetných mineráloch, ako sú kremičitany, fosfáty, oxidy, sulfidy, seleniuros atď.
Na druhej strane slovo „ampigén“ znamená „schopný tvoriť kyslé alebo základné zlúčeniny“. Jednoduchým príkladom je skutočnosť, že existujú kyslé a základné oxidy.
Kyslík sa nedá nájsť nielen vo vzduchu, ktorý je dýchaný, ale je tiež súčasťou 49% zemskej kôry. Preto nestačí pozerať sa na oblaky, aby ich mali mať hlavu a uvažovať o maximálnom fyzickom prejavení kalkogénov, je potrebné navštíviť horu alebo rudu.
Horný obrázok zobrazuje stĺpec alebo skupinu so všetkými jeho prvkami na čele s kyslíkom. Pomenovanie v potomkovom poradí je: kyslík, síra, selén, telurio a polonium.
Aj keď to nie je znázornené, syntetický, rádioaktívny prvok je umiestnený pod poloniom a druhý najťažší po Oganeseone: Light (LV).
Kyslík
Kyslík sa nachádza v prírode hlavne ako dva alotropy: o2, molekulárny alebo diatomický kyslík a O3, ozón. Je to plyn v pozemských podmienkach a získava sa skvapalnením vzduchu. V kvapalnom stave predstavuje bledo modré tóny a vo forme ozónu môžu tvoriť červenkasté hnedé soli nazývané orzónidos.
Môže vám slúžiť: hydroxid amónnySíra
Prirodzene predstavuje dvadsať rôznych alotropov, ktoré sú najbežnejšie zo všetkých, S8, „Koruna Síry“. Síra je schopná formovať sa so sebou cyklickými molekulami alebo špirálovými reťazcami s kovalentnou väzbou S-S ... Toto je známe ako katenácia.
Za normálnych podmienok je to žltá tuhá látka, ktorej červenkasto a zelenkavé sfarbenie závisí od počtu atómov síry, ktoré tvoria molekulu. Iba v plynnej fáze sa nachádza ako diatomická molekula s = s, s2, podobné molekulárnemu kyslíku.
Selén a Telurio
Selén tvorí krátke reťazce ako síra, ale s dostatočnou štrukturálnou diverzitou na nájdenie červených, kryštalických a čiernych amorfných alotropov.
Niektorí to považujú za metaloid a iní za nemetalický prvok. Prekvapivo je to nevyhnutné pre živé organizmy, ale vo veľmi nízkych koncentráciách.
Telurio, na druhej strane, kryštalizuje ako sivastú pevnú látku a má vlastnosti a vlastnosti metaloidu. Je to veľmi vzácny prvok v zemskej kôre, ktorý sa nachádza v malých koncentráciách v zriedkavých mineráloch.
Polónium
Zo všetkých kalkogénov je to jediný kovový prvok, ale rovnako ako jeho 29 izotopov (a ďalšie), je nestabilný, vysoko toxický a rádioaktívny. Nachádza sa ako stopa v niektorých mineráloch uránu a tabakového dymu.
Vlastnosti
Elektronická konfigurácia a stavy Valencia
Všetky kalkogény majú rovnakú elektronickú konfiguráciu: NS2Np4. Majú, existuje šesť elektrónov Valencie. Keďže sú v bloku P, na pravej strane periodickej tabuľky, majú tendenciu získať viac elektrónov ako stratiť ich, preto dva elektróny zarábajú na dokončenie svojej oktetu Valencie a v dôsledku toho získajú Valenciu z -2.
Môže vám slúžiť: chlorid lítium (LICL): vlastnosti, riziká a použitiaMôžu tiež stratiť svoje šesť elektrónov vo Valencii, keď sú so stavom +6.
Možné stavy Valencie pre kalkogény sa pohybujú od -2 do +6, pričom tieto dva sú najbežnejšie. Keď skupina zostupuje (od kyslíka po polonium), zvyšuje sa tendencia prvkov prijímania pozitívnych stavov valencie, čo sa rovná zvýšeniu kovového charakteru.
Napríklad kyslík získava takmer vo všetkých svojich zlúčeninách stav Valencie -2, s výnimkou prípadov, keď sa tvorí fluorid, čo ho núti stratiť elektróny v dôsledku svojej väčšej elektronegativity a prijíma stav valencie +2 (2). Peroxidy sú tiež príkladom zlúčenín, v ktorých má kyslík Valencia od -1 a nie -2.
Kovový a nemetalický charakter
Keď skupina zostupuje, atómové rádiá sa zvyšujú a s nimi sú chemické vlastnosti prvkov upravené. Napríklad kyslík je plyn a termodynamicky je stabilnejší ako diatomická molekula o = o, ako „okysličený reťazec“ O-O-O-O ..
Je to skupina väčšieho nemetalického charakteru skupiny, a preto tvorí kovalentné zlúčeniny so všetkými prvkami bloku P a s niektorými prechodnými kovmi.
Non -metalický charakter klesá so zvyšujúcim sa kovovým charakterom. Odráža sa to vo fyzikálnych vlastnostiach, ako sú body varu a fúzie, ktoré sa zvyšujú zo síry na polonium.
Ďalšou charakteristikou zvýšenia kovového charakteru je zvýšenie kryštalických konfigurácií zlúčenín vytvorených teluriom a poloniumom.
Zloženia
Niektoré zlúčeniny tvorené pomocou kalkogénov sú všeobecne uvedené nižšie.
Môže vám slúžiť: Isopentano: Štruktúra, vlastnosti, použitie, získanieHydrors
-H₂o
-H2Siež
Podľa nomenklatúry IUPAC sa nazýva ako sulfid vodíka a nie hydrid síry, pretože H nemá Valencia -1.
-H2On
Podobne sa nazýva vodík seleniuro, ako aj zvyšok hydros.
-H2Čaj
-H2Po
Kyslíkový hydrid je voda. Ostatné sú páchnuce a jedovaté, pretože by ste boli2Je najznámejší zo všetkých, dokonca aj v populárnej kultúre.
Sulfidy
Všetci majú spoločné anióny s2- (Najjednoduchšie). Medzi nimi sú:
-Mgs
-Fes
-Krutosť2
-Nat2Siež
-Bas
Rovnakým spôsobom sú tu Selenuros, viem2-, Telenuros, TE2-, a Polonuros, po2-.
Halogenuróz
Kalkogény môžu tvoriť zlúčeniny s halogénmi (F, Cl, Br, I). Niektoré z nich sú:
-Tei2
-Siež2F2
-Z2
-Scl2
-SF6
-SEBR4
Oxidy
Nakoniec existujú oxidy. V nich má kyslík valenciu -2 a môže byť iónová alebo kovalentná (alebo má vlastnosti oboch). Majú napríklad tieto oxidy:
-SW2
-Teo2
-Zápis2Ani
-Vernosť2Ani3
-H₂o (oxid vodíka)
-SEO3
Existujú ďalšie stovky tisíc zlúčenín, ktoré zahŕňajú zaujímavé tuhé štruktúry. Okrem toho môžu prezentovať polycyctions alebo polycytions, najmä v prípade síry a selénu, ktorých reťazce môžu získať pozitívne alebo negatívne zaťaženie a interagovať s inými chemickými druhmi.
Odkazy
- Chalcogény. ADVAMEG. Zotavené z chémie.com.

