Butánska štruktúra, vlastnosti, použitia a riziká
- 4649
- 946
- Adrián Fajnor
On Butánsky Je to aldehyd s otvoreným reťazcom, pozostávajúci zo štyroch atómov uhlíka a je analogický butánu; Je to v skutočnosti druhá najviac oxidovaná forma butánového uhľovodíka po kyseline maslovej. Jeho molekulárny vzorec je Cho3Chvály2Chvály2Cho, kde -cho je formilová skupina.
Tento aldehyd, jeden z najľahších, pozostáva z priehľadného, horľavého a menej hustého tekutiny ako voda. Okrem toho je rozpustný vo vode a miešateľný s väčšinou organických rozpúšťadiel; Preto sa dá použiť na to, aby mal jednofázové organické zmesi.
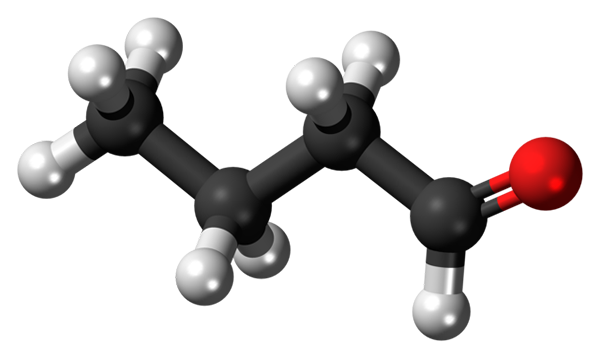
 Bután alebo butiraldehyd molekula. Zdroj: Jynto [CC0]
Bután alebo butiraldehyd molekula. Zdroj: Jynto [CC0] Prítomnosť karbonylovej skupiny (prítomnosť červenej gule, vynikajúci obraz) dáva chemickej polarite butánskej molekuly, a preto schopnosť zažiť interakciu dipólu-dipolo medzi jeho molekulami; Aj keď medzi nimi nie sú vytvorené žiadne vodíkové mosty.
To prináša v dôsledku toho, že Butanal predstavuje varné a fúzne body väčšie ako bután, ale menej ako tie, ktoré prezentuje N-boulalkohol.
Butanal sa používa ako rozpúšťadlo a je sprostredkovateľom na získanie početných výrobkov; ako sú urýchľovače vulkanizácie gumov, živíc, farmaceutických a agrochemických výrobkov.
Butanal je toxická zlúčenina, ktorá vdýchnutie môže spôsobiť zápal horných dýchacích ciest, bronchi a pľúcny edém, ktorý dokonca môže mať smrteľné následky.
[TOC]
Butánska štruktúra
Práve sa uvádza, že skupina Formil, -ch. V dôsledku toho ich molekuly môžu navzájom interagovať prostredníctvom dipólových dippolových síl.
Môže vám slúžiť: Rotary Sušer: Prevádzka, pre čo je, časti, aplikácieNa hornom obrázku je znázornené s modelom guľôčok a tyčí, že butánska molekula má lineárnu štruktúru. Uhlíka skupiny má hybridizáciu SP2, zatiaľ čo zostávajúce uhlíky3.
Nielen to, ale je to tiež flexibilné a ich odkazy sa môžu otáčať na svojich vlastných osiach; A tak sa generujú rôzne konformácie alebo konformátory (rovnaká zlúčenina, ale s ich rotačnými odkazmi).
Konforméry
Tento bod najlepšie vysvetľuje nasledujúci obrázok:
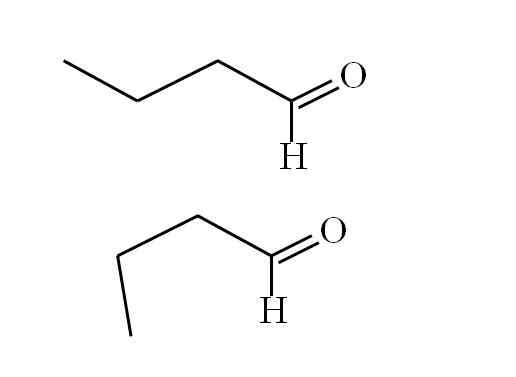 Bután. Zdroj: Gabriel Bolívar.
Bután. Zdroj: Gabriel Bolívar. Prvý konformér (Superior) zodpovedá molekule prvého obrázka: metylová skupina vľavo, -ch3, a skupina -cho, sú v anti paralelných pozíciách; jeden bod nahor a druhý dole, respektíve.
Medzitým druhý konformér (dolný) zodpovedá molekule s -ch3 a -ho v zatienených pozíciách; to znamená, oba body rovnakým smerom.
Obidva konforméry sú rýchlo zameniteľné, a preto sa butánska molekula otáča a neustále vibruje; A dodal skutočnosť, že má trvalý dipól, to umožňuje, aby jeho interakcie boli dostatočne silné na to, aby sa varilo pri 74,8 ° C.
Vlastnosti
Chemické názvy
-Butánsky
-Butiraldehyd
-1-butánsky
-Butirálny
-N-butiraldehyd.
Molekulárna receptúra
C4H8Alebo CH3Chvály2Chvály2Choď.
Fyzický vzhľad
Je to jasná, priehľadná kvapalina.
Vôňa
Charakteristická vôňa, aker, aldehyd.
Bod varu
167 ° F pri 760 mmHg (74,8 ° C).
Bod topenia
-146 ° F (-96,86 ° C).
zapaľovač
-8 ° F (-22 ° C) uzavreté sklo.
Rozpustnosť
7 g/100 ml pri 25 ° C.
Rozpustnosť v organických rozpúšťadlách
Misilné s etanolom, éterom, etylacetátom, acetónom, toluénom a mnohými ďalšími organickými rozpúšťadlami.
Hustota
0,803 g/cm3 pri 68 ° F.
Môže vám slúžiť: dusičnany: vlastnosti, štruktúra, nomenklatúra, školenieHustota
2,5 (vo vzťahu vzduchu sa rovnajú 1).
Tlak vodnej pary
111 mmHg pri 25 ° C.
Sebaprečovanie
446 ° F. 425 ° F (21,8 ° C).
Hrebeň
0,45 CPoise pri 20 ° C.
Spaľovacie teplo
2479,34 kJ/mol pri 25 ° C.
Odparovanie
33,68 kJ/mol pri 25 ° C.
Povrchové napätie
29,9 dina/cm a 24 ° C.
Prah
0,009 ppm.
Index lomu
1 3843 až 20 ° C.
Dipolárny moment
2,72 d.
Vlnové dĺžky (λ) maximálnej absorpcie vo vode
225 nm a 282 nm (ultrafialové svetlo).
Polymerizácia
Butanal sa môže polymerizovať v kontakte s alkalismi alebo kyselinou, ktorá je nebezpečná polymerizácia.
Reaktivita
Pri vystavení oxidovanej vzduchu, ktorá sa tvorí kyselina maslová. Pri teplote 230 ° C je bután spontánne zapálený vzduchom.
Aldolická kondenzácia
Dve butánske molekuly môžu navzájom reagovať, v prítomnosti KOH a teploty 6-8 ° C, za vzniku zlúčeniny 2-etyl-3-hydroxyhexanolu. Tento typ zlúčeniny sa nazýva aldol, pretože má skupinu aldehydov a alkoholickú skupinu v jej štruktúre.
Syntéza
Butanal sa môže vyskytnúť katalytickou dehydrogenáciou N-butylalkoholu; katalytická hydrogenácia crotonaldehydu; a propylénová hydroformilácia.
Žiadosti
Priemyselný pracovník
-Butanal je priemyselné rozpúšťadlo, ale je tiež sprostredkovateľom v syntéze iných rozpúšťadiel; Napríklad 2-etylhexanol, N-butanol a trimetylpropán.
-Používa sa tiež ako sprostredkovateľ pri vypracovaní syntetických živíc, medzi nimi, butirálny polyvinil; urýchľovače vulkanizácie gumy; Výroba farmaceutických výrobkov; výrobky na ochranu plodín; pesticídy; antioxidanty; Asistent.
-Butanal sa používa ako surovina na vypracovanie syntetických arómov. Okrem toho sa používa ako činidlo s príchuťou potravín.
Môže vám slúžiť: bromid sodný (NABR)Ďalší
-U človeka sa butanal používa ako biomarker svedectvo o oxidačnom poškodení, ktoré sa vyskytujú lipidmi, proteínmi a nukleovými kyselinami.
-Experimentálne sa používala, spolu s formalínom a gluterdehydom, aby sa pokúsila znížiť zmäkčenie, ktoré sa vyskytli hovädzie prilby v dôsledku vystavenia vode, moču a výkalov hovädzieho dobytka sami. Experimentálne výsledky boli pozitívne.
Riziká
Butanal je deštruktívny pre slizničné tkanivové membrány horných dýchacích ciest, ako aj pre tkanivá kože a očí.
Kontaktom s pokožkou vytvára sčervenanie a popáleniny. V očiach sa vyrábajú rovnaké lézie, sprevádzané bolesťou a poškodením očného tkaniva.
Vdychovanie butánu môže mať vážne následky, pretože môže spôsobiť bronchiály z hrtanu a zápal a opuchy; Zatiaľ čo v pľúcach, produkuje chemickú pneumóniu a pľúcny edém.
Príznaky nadmerného expozície zahŕňajú: nadšené pocity na hornom dýchacom trakte, kašeľ, pískanie, to znamená emisie píšťalky pri dýchaní; laryngitída, nedostatok dychu, bolesti hlavy, nevoľnosť a tiež zvracanie.
Inhalácia môže byť smrteľná v dôsledku kŕčov opravných ciest.
Požitie butánu spôsobuje pocit „pálenia“ na tráviacich cestách: orálna dutina, hltaj, pažerák a žalúdok.
Odkazy
- Morrison, r. Tón. A Boyd, r. N. (1987). Organická chémia. (5ubytovať sa Vydanie.). Redakcia Addison-Wesley Iberoamericana.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Publikácia. (2019). Butánsky. Získané z: pubchem.Ncbi.Nim.NIH.GUV
- Wikipedia. (2019). Butánsky. Obnovené z: je.Wikipedia.orgán
- Chemická kniha. (2017). Butánsky. Obnovené z: Chemicalbook.com
- Basf. (Máj 2017). N-butyraldehyd. [PDF]. Zdroj: rozpúšťadlá.Basf.com
- « Primárne uhlíkové charakteristiky, typy a príklady
- Charakteristiky integrálneho vzdelávania a ako to dosiahnuť »

