Hliníkový bromid
- 3199
- 513
- Denis Škriniar
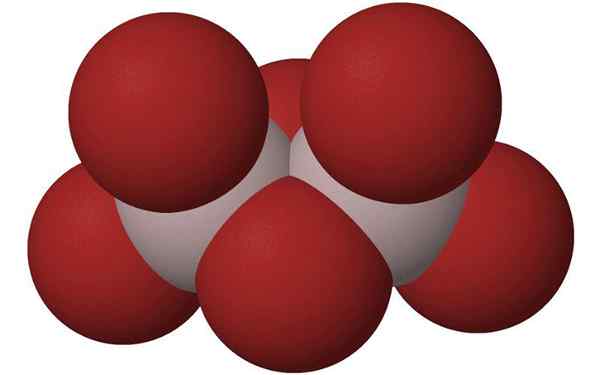
 Sféra hliníkového bromidového diméru. Zdroj: HOA112008, Wikimedia Commons
Sféra hliníkového bromidového diméru. Zdroj: HOA112008, Wikimedia Commons Čo je hliníkový bromid?
On Hliníkový bromid Je to zlúčenina tvorená atómom hliníka a rôznym množstvom atómov brómu. Sa tvorí v závislosti od množstva valenčných elektrónov, ktoré má hliník.
Ako zlúčenina pripevnená kovom (hliník) a net -kov (bróm), tvoria sa kovalentné väzby, ktoré dodávajú štruktúram veľmi dobrú stabilitu, ale bez toho, aby dosiahli stabilitu iónovej väzby.
Bromid hliníka je látka, ktorá je normálne prezentovaná v tuhom stave, s kryštalickou štruktúrou. Farby rôznych hliníkových bromuros sa javia ako bledožlté z rôznych odtieňov a niekedy sa prezentuje bez zjavnej farby.
Farba závisí od kapacity odrazu svetla, ktorú má zlúčenina a zmeny v závislosti od vytvorených štruktúr a tvarov, ktoré berie.
Pevný stav týchto zlúčenín kryštalizuje, takže majú dobre definované štruktúry s vzhľadom podobným morskej soli, ale mení ich farbu.
Vzorec
Bromid hliníka sa skladá z atómu hliníka (AL) a rôznych množstiev atómov brómov (BR) v závislosti od valenčných elektrónov, ktoré majú hliníkový hliník.
Preto je možné zapísať všeobecný vzorec hliníkového bromidu nasledovne: ALBX, kde „x“ je počet atómov brómu, ktoré sa viažu na hliník.
Najbežnejším spôsobom, akým je prezentovaný, je ako2Br6, čo je molekula s dvoma hliníkovými atómami ako hlavné základy štruktúry.
Môže vám slúžiť: laktofenol modrá: charakteristiky, zloženie, príprava, použitiaPrepojenia medzi nimi tvoria dvoma brómami uprostred, takže každý atóm hliníka má vo svojej štruktúre štyri atómy brómu, ale naopak dva zdieľajú dva.
Vlastnosti a charakteristiky hliníkového bromidu
- Vďaka svojej povahe je vysoko rozpustný vo vode, ale je tiež čiastočne rozpustný v zlúčeninách, ako je metanol a acetón, na rozdiel od iných látok.
- Má molekulovú hmotnosť 267 g/mol a tvorí sa kovalentnými väzbami.
- Bromid sodný dosahuje svoj bod varu pri 255 ° C a dosiahne svoj bod topenia na 97.5 ° C.
- Ďalšou charakteristikou tejto zlúčeniny je to, že pri odparovaní vyžaruje toxíny, takže sa to neodporúča.
Žiadosti
- Jedným z použití tohto typu látky, kvôli jej kovovej a nemetalickej povahe, je to, čo sa týka činidiel v chemických testoch čistoty. Tieto testy čistoty sú veľmi dôležité na určenie kvality reagencií a výrobu výrobkov, s ktorými sú ľudia spokojní.
- Vo vedeckom výskume sa používa veľmi variabilným spôsobom. Napríklad na vytvorenie komplexných štruktúr, činidiel v syntéze iných chemikálií hodnoty, pri hydrogenácii dihydroxinaftalénov a pri selektivite v reakciách.
- Táto zlúčenina nie je komerčne populárna. Ako je uvedené vyššie, má niektoré aplikácie, ktoré sú veľmi špecifické, ale veľmi zaujímavé pre vedeckú komunitu.
Odkazy
- Chang, R. (2010). Chémia. McGraw-Hill Inter-American.
- Krahl, T., & Kemnitz a. (2004). Amorfný fluorid bromidu eiringum (ABF). Angewandte Chemie - medzinárodné vydanie.

