Štruktúra borohydridu sodného (NABH4), vlastnosti, použitie

- 1352
- 382
- JUDr. Rudolf Čapkovič
On bór sodný Je to anorganická tuhá látka, ktorej chemický vzorec je nabh4. Môže sa považovať za reprezentatívny pre alkalické borohydruros a je z nich najbežnejším. Je to kryštalická biela pevná látka.
Po kontakte s vodou, nabh4 môže vytvárať teplo a vodík H2 čo je palivo, takže sa musí zaobchádzať opatrne. Pre ľahkosť, s akou môže generovať hydridové ióny h-, Bór sodný je mierne redukčná zlúčenina, takže sa na tento účel široko používa v chemických reakciách.
 Borohydrid sodný, NABH4, tuhý. Ondřej Mangl [verejná doména]. Zdroj: Wikimedia Commons.
Borohydrid sodný, NABH4, tuhý. Ondřej Mangl [verejná doména]. Zdroj: Wikimedia Commons. Jeho redukčná vlastnosť sa používa aj v papierovom priemysle, pretože umožňuje zlepšiť charakteristiky jasu a stability buničiny a papiera pri pôsobení proti oxidácii celulózy, hlavnej zložky papiera.
Pretože v prítomnosti vody môže ľahko tvoriť vodík, skúmala sa aj možnosť jeho použitia ako reverzibilného zdroja vodíka v palivových článkoch.
Má ďalšie použitia na základe jeho redukčného majetku, napríklad vo farmaceutickom priemysle.
[TOC]
Štruktúra
Bór sodný je iónová zlúčenina. Je tvorený aniónom borohydridu [bh4]- spolu s katiónom sodným+.
Anión [bh4]- Je to štrk.
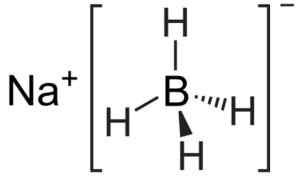 Štruktúra borohydridu sodného. Kemikungen [verejná doména]. Zdroj: Wikimedia Commons.
Štruktúra borohydridu sodného. Kemikungen [verejná doména]. Zdroj: Wikimedia Commons. Jeho štruktúra Lewis je nasledovná:
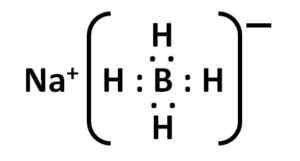 Elektronická štruktúra nabh Lewis4. Autor: Marilú Stea.
Elektronická štruktúra nabh Lewis4. Autor: Marilú Stea. Menovanie
-Bór sodný
-Tetrahydroát sodný
-Tetrahydrurorat sodný
Fyzikálne vlastnosti
Fyzický stav
Kryštalická biela pevná látka.
Molekulová hmotnosť
37,84 g/mol
Teplota
∼ 220 ° C
Teplota rozkladu
> 250 ° C
Hustota
1 074 g/cm3 pri 20 ° C
Môže vám slúžiť: Grignard Reagent: Príprava, aplikácie, príkladyRozpustnosť
Nabh4 Je celkom rozpustný vo vode (55 g/100 ml pri 25 ° C), kde čiastočne hydrolyzuje. Je rozpustný v tetrahydrofurane (THF) a je nerozpustný v ditel éteru.
Chemické vlastnosti
Bór sodný sa rozpustí vo vode, kde trpí počiatočným rozkladom alebo hydrolýzou, vďaka ktorej je roztok základný, čo zabraňuje následnej hydrolýze.
[BH4]- + H2O → B (OH)3 + H2↑ + Oh-
To je vysvetlené, pretože [BH4]- interagovať s h+ Vody, kde h+ Vezmite hydrid- Na vytvorenie h2. Dá sa povedať, že BH3 súťaží s H+ Pre hydrid h-.
V kyslej strednej hydrolýze je kompletná kvôli množstvu H iónov+.
Nabh4 Je stabilný v suchom vzduchu. Nie je to prchavé.
Vďaka obsahu hydridového iónu je bór sodný redukčnou zlúčeninou. Umožňuje znížiť karbonylovú skupinu C = o C-OH, to znamená karbonylové zlúčeniny na alkoholy.
Nabh4 Samotné neznižuje dvojité väzby c = c, ani konjugáty s karbonyl skupinami -c = c -c (= o)-.
Avšak pri príchode do kontaktu s protonovými kyselinami (napríklad HCl) alebo Lewisovými kyselinami (napríklad BCL3 alebo ALCL3) Sa vytvára Diborano B2H6. A ak sa táto reakcia vykonáva v prítomnosti organických zlúčenín s dvojitými väzbami C = C Diborano B2H6 Vykonáva ich hydrobacion.
V prítomnosti vhodných katalyzátorov a špecifických podmienok môže bór sodný znížiť rôzne typy funkčných skupín.
Riziká
Teplo hydrolýzovej reakcie vo vode stačí na zapnutie vodíka, ktorý je v ňom vytvorený. Preto je dôležité byť opatrný pri manipulácii.
Nabh4 Je ľahko zapnutý a ľahko sa spáli.
Získanie
Typická reakcia na prípravu NABH4 Je to cez hydrid sodný NAH a B (Och3)3 Pri teplote asi 250 ° C:
Môže vám slúžiť: elektrolýza vody4 NAH + B (OCH3)3 → Nabh4 + 3 Naoch3
Žiadosti
Pri chemických reakciách redukcie
Za to, že je zdrojom honov h-, Nabh4 Je to redukčná zlúčenina a používa sa na prípravu ďalších chemických zlúčenín. Na tento účel sa používa v apratotických polárnych rozpúšťadlách, tj bez H protónov+, ako je dimetylsulfoxid, hexametylfosforálny a dimetyloloformid.
Používa sa ako redukčné činidlo v organických aj anorganických reakciách chémie.
Umožňuje redukovať aldehydos na primárne alkoholy a ketóny na sekundárne alkoholy.
Znižuje tiež alkylhalogenidy na uhľovodíky, ako je jododan na dekana.
Ak pôsobí samostatne, pri redukcii neovplyvňuje iné funkčné skupiny, ako je ester, kyselina karboxylová, nitril a sulfón.
Jeho vlastnosť neznižuje dvojité väzby c = c, dokonca ani konjugáty s karbonylovými skupinami -c = c-c (= o)-umožňuje vám pripraviť nenasýtené alkoholy -c =2-Oh.
Na zníženie aromatických zlúčenín nitrados na ich zodpovedajúce anilíny vyžadujú prítomnosť katalyzátorov, ako je chlorid kobaltu alebo cín. Znížte disulfidy na tioly.
V prítomnosti vhodných podmienok a katalyzátorov umožňuje redukovať karboxylové kyseliny, estery, uprostred, dusičnany, imin, epoxidy a dokonca aj dvojité a trojité väzby.
V h2 V palivových článkoch
Nabh4 Môže sa zmeniť na palivový článok.
Nabh4 V prítomnosti alkalického roztoku KOH alebo NaOH je hydrolyzovaný a produkuje vodík H2 ktoré sa môžu použiť ako palivo v polymérnej elektrolytovej palivovej batérii.
Bol tiež skúmaný ako materiál H na skladovanie H2 zvrátene.
Nanočastice NABH sú syntetizované4 a stabilizujte pomocou povrchovo aktívnej látky. Po liečbe NICL2 Vytvára sa ochranná vrstva alebo povlak, ktorý reguluje uvoľňovanie H2 úplne reverzibilne.
Môže vám slúžiť: dusičnan strieborný (AGNO3): Štruktúra, vlastnosti, použitie, toxicitaTento nový nanometrický materiál by umožnil použitie H2 ako čisté a obnoviteľné palivo.
 Vozidlo, ktoré pracuje s vodíkovými palivovými článkami. DR. Artur Braun (Artubraun) [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Vozidlo, ktoré pracuje s vodíkovými palivovými článkami. DR. Artur Braun (Artubraun) [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. V priemysle buničiny a papiera
Bór sodný sa používa na zlepšenie jasu a iných fyzikálnych vlastností buničiny a papiera.
Degradácia celulózovej matrice papiera sa vyskytuje prostredníctvom komplexných procesov, ktoré zahŕňajú oxidáciu. Hydroxylové skupiny oxidujú karbonyl a karboxyl, čo vedie k sfarbeniu papiera a zníženiu fyzikálnych vlastností.
Pri liečbe buničiny alebo papiera nabh4, To redukuje aldehydos a ketóny na skupiny -OH bez ovplyvnenia kyslých karboxylových skupín, zlepšuje stabilitu a jas na hodnoty väčšie ako iniciály.
 Nabh4 umožňuje zlepšiť jas papiera. Autor: Rawpixel. Zdroj: Pixabay.
Nabh4 umožňuje zlepšiť jas papiera. Autor: Rawpixel. Zdroj: Pixabay. Na niekoľkých použitiach
Bór sodný sa používa na ošetrenie odpadových vôd, ako srdečného činidla v potravinárskom a nápojovom priemysle, ako povlaku a na ošetrenie povrchov, pri výrobe tabaku, vo farmaceutickej, textilnej a textilnej koženej koženej kože.
Odkazy
- Christian, M.L. a Aguey-Zinsou, K.-F. (2012). Stratégia jadrovej siete vedúca k vysoko reverzibilnej kapacite skladovania vodíka pre NABH4. ACS Nano 2012, 6, 9, 7739-7751. Získané z krčiem.ACS.orgán.
- Nora de Souza, m.Vložka. a Alves v., Tón.R. (2006). Nedávne metodiky sprostredkované borohydridom sodným pri znižovaní rôznych tried zlúčenín. Aplikácia. Organometálny. Chem. 2006; 20: 798-810. Zdroj: z online knižnice.Mravný.com.
- IMamoto, T. (1991). Zníženie. Borohydrid sodný. Pri porozumení organickej syntézy. Zotavené z vedeckých pracovníkov.com.
- Tang, L.C. (1986) Stabilizácia papiera pomocou ošetrenia borohydridu sodným. V historických textilných a papierových materiáloch. Kapitola 24. Strany 427-441. Pokroky v chémii, zväzok 212. Získané z krčiem.ACS.orgán.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Morrison, Robert Thornton; a Boyd, Robert Neilson. 1992. Organická chémia. Hara. ISBN 81-203-0765-8.
- Alebo.Siež. Lekárska knižnica. (2019). Borohydrid sodný. Získané z: pubchem.Ncbi.NLM.NIH.Vláda.
- « Charakteristiky a príklady sociálneho fenoménu
- Chlorid kobaltu (COCL2 (štruktúra, nomenklatúra, vlastnosti »

