Biftalátová štruktúra draslíka, nomenklatúra, použitie, riziká
- 979
- 1
- Tomáš Klapka
On biftalát draslíka Je to chemická, pevná, biela, rozpustná zlúčenina, ktorá je komerčne v stave vysokej čistoty. Používa sa ako primárny vzorec na štandardizáciu roztokov v kvalifikácii na báze kyseliny; Používa sa tiež ako roztok pufra na udržanie stabilného pH roztokov.
Je to stabilná, nehygroskopická zlúčenina, ktorá uľahčuje prípravu roztoku, pretože počas ťažkého procesu neabsorbuje vodu. Môže sa pripraviť reakciou medzi fotálnou kyselinou a roztokom KOH, v ktorom je vodík molekuly kyseliny ftalovej nahradený atómom draslíka.
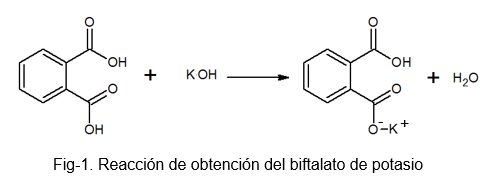
Biftalát draselného prijíma tento názov, pretože vo svojej molekule je mierne kyslý vodík. Tento vodík je ten, ktorý sa nachádza v skupine -OH, ktorá sa nachádza hneď vedľa karbonylovej skupiny, ktorá je súčasťou karboxylu, ktorý nereaguje. Tento typ soli sa nazýva kyslé soli, pretože nie sú úplne neutrálne.
[TOC]
Chemická štruktúra

Vzorec
C6H4COOHCOOK = C8H5 Kolo4
Menovanie
- Biftalát draslíka.
- Phtalát kyseliny draselnej.
- Vodík draslíka.
Vlastnosti
Hustota
1636 g/ml.
Molárna hmota
204.22 g/mol.
Rozpustnosť
Voda a alkohol.
Bod topenia
295 ° C s rozkladom.
Aspekt
Biela -biela pevná látka.
Špecifická váha
1,64 GR/CM3.
Derivát derivátu draselného draselného
Derichrografické merania ukázali, že rozklad biftalátu draselného sa začína medzi 190 ° C a 200 ° C a nehygroskopický prípravok sa môže pripraviť medzi 100 ° C a 150 ° C.
Rozklad prebieha v troch krokoch, ktorých rýchlosť závisí od rýchlosti pri zvýšení teploty: ftalát dipbotasného sa prvýkrát vytvorí, phtalický anhydrid a voda sa eliminujú.
Môže vám slúžiť: chlorid vápenatý (CACL2)Zmeny entalpía je možné získať aj z derivátu, čo vytvára informácie o dodatočnom mechanizme tepelného rozkladu a zmenách stavu vzorky.
Použitia a aplikácie
Táto zlúčenina sa používa v analytickej chémii v titrácii alebo hodnotení kyseliny ako primárny vzorec štandardizácie pri príprave roztokov z rôznych zlúčenín.
Štandardizácia bázy (alkali = NaOH)
Pri príprave roztoku NaOH nie je možné zaručiť, že koncentrácia, s ktorou riešenie zostáva, je správna; Dôvodom je, že NaOH je veľmi hygroskopická tuhá látka (absorbujte vzduch zo vzduchu) a aby ju zvážil, zostáva s nejakou vlhkosťou, čo robí množstvo látky nie je najoptimálnejšou.
Akonáhle je roztok pripravený, je potrebné presne vedieť, akú koncentráciu zostala.
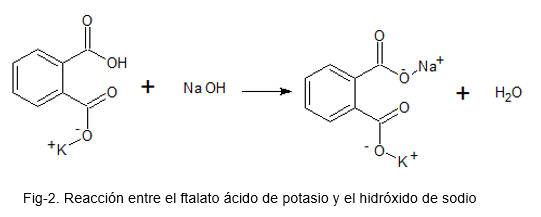
Na tento účel sa roztok pripravuje s ftalátom kyseliny draselnej, ktorá je primárnym vzorom (kvôli jeho vysokej stabilite); Pridá sa niekoľko kvapiek indikátora kyseliny fenolftaleínovej kyseliny a roztok NaOH ako názov sa pridá, až kým sa v roztoku ftalátu kyseliny draselnej.
Pri získaných údajoch sa uskutočňujú príslušné výpočty, aby sa našla skutočná koncentrácia NaOH.
Nasledujúci obrázok ilustruje chemickú reakciu medzi ftalátom kyseliny draselnej a hydroxidom sodným.

Ako roztok pufra pri stanovení pH
Roztok pufra alebo roztoku pufra je ten, ktorý je tvorený kyslou aj kyslou soľou, to spôsobuje, že zostane v podmienkach tak, aby sa hodnota pH nemenila, keď sa pridá malé množstvo kyseliny alebo bázy.
Môže vám slúžiť: gravimetria: gravimetrická analýza, metódy, použitia a príkladyRiziká
- Vystavenie požiaru. Rovnako ako u väčšiny organických tuhých látok je možné, že sa môže vyskytnúť oheň pri vysokých teplotách alebo kontaktom so zdrojom zapaľovania.
- Jemný prach sa rozptýli vo vzduchu v dostatočných koncentráciách a v prítomnosti zdroja zapaľovania je potenciál nebezpečného výbuchu prachu.
- Je to stabilná látka pri izbovej teplote a pri primeraných skladovacích podmienkach. Malo by sa vyhnúť nadmernému tepla a vlhkosti.
- Môže byť nezlučiteľná so silnými oxidantmi, ako je kyselina dusičná.
- Rozklad môže tvoriť oxidy uhlíka, ktoré sú toxické.
Týkajúce sa zdravia
- Náhodným požitím môže spôsobiť zvracanie, hnačku a podráždenie v membránach kvôli ich kyslosti.
- Vdýchnutím spôsobuje podráždenie dýchacích ciest a kašľa.
- V koži spôsobuje podráždenie.
- V očiach spôsobuje podráždenie, začervenanie a bolesť.
- Predpokladá sa, že nejde o karcinogénnu, teratogénnu alebo mutagénnu látku.
Pohotovosť a prvá pomoc
- Umyte oči veľkým množstvom vody, odstráňte spomalenie v prípade ich prepravy a nechajte vodu pretekať očami bez toho, aby sa dotkli rukami.
- Ak došlo k kontaktu s pokožkou, odstráňte kostýmy a obuv, umyte sa s veľkým množstvom vody a pred použitím znova umyte odevy.
- V prípade požitia sa vyhnite provokovaniu zvracania, pitnej vody.
- V prípade vdýchnutia vezmite osobu, aby dýchala čerstvý vzduch; V prípade zložitého dychu dodajte kyslík.
- Vo všetkých prípadoch požiadajte o urgentnú lekársku pomoc.
- V prípade únikov alebo rozliatia zbierajte produkt v čistej nádobe a pokúste sa rozptýliť prach.
Môže vám slúžiť: aké sú negatívne účinky, ktoré máme s rozpustnosťou vody?Opatrenia na osobnú ochranu
- Zostaňte mimo miesta, kde sa skladujú nápoje, jedlo a krmivo (jedlo pre domáce zvieratá).
- Používajte anti prachové masky, neoprénové alebo PVC rukavice. V súčasnosti sa používajú nitrilové rukavice.
- Noste primerané oblečenie, ktoré zakrývajú väčšinu tela, vrátane zakrytých topánok alebo obuvi a bezpečnostných okuliarov.
- Odporúča sa lokálne výfukové vetranie so systémom extraktora vzduchu, pričom sa berú do úvahy prevládajúci smer vetra.
- Produkt je miešateľný vo vode, nie je absorbovaný na zemi, nie je bioakumulovateľný alebo biologicky odbúrateľný, neočakáva sa, že ovplyvní vodný život. V čase jeho vyradenia sa však musí urobiť pomocou špecializovaného personálu: neodstráňte odtokom.
- Skladujte v oranžovej/zelenej oblasti, čerstvé suché a vetrané miesto a oddelené od nekompatibilného materiálu.
Odkazy
- Merck, (s.f), Merckmillipore.com
- Chang R.,(1992), chémia, (štvrté vydanie), Mexiko, McGraw-Hill Inter-American z Mexika S.A, z c.Vložka
- Meyer Chemistry Reagents, (S.f), list o bezpečnostných údajoch, Bifthalát draselného, získaný z ReagentsMeyer.com.mx
- Belcher, r.,Erdey, L.,Paulik, f.,Lesk.G.,(Júl 1960), oheň Draselný hydroghateftalát, Vedecký, Zväzok 5, vydanie 1, Strany 53-57, org/10.1016/0039-9140 (60) 80205-6

