Beta galaktozidáza Charakteristiky, štruktúra, funkcie
- 2079
- 137
- Alan Milota
Ten Beta galaktozidáza, Tiež nazývaná p-galaktozidáza alebo p-d-galaktohydroly je enzým patriaci do rodiny glykozilových hydroláz schopných hydrolyzujúceho galaktozylového odpadu rôznych druhov molekúl: polyméry, oligosacharidy a sekundárne metabolity,.
Predtým známy ako „laktáza“, jej distribúcia, ako aj distribúcia polysacharidov oligo a p-galaktity, ktoré slúžia ako substrát, sú extrémne široké. Nachádza sa v baktériách, húb a kvasinkách; V rastlinách je bežný v mandľoch, broskyniach, marhuľových a jablkách a u zvierat je prítomný v orgánoch, ako sú žalúdok a črevá.
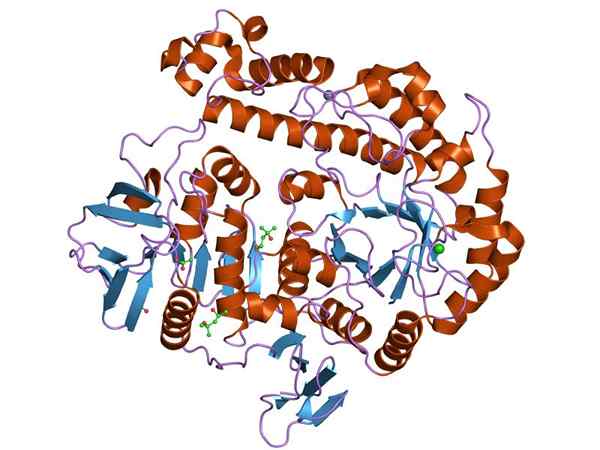
 Grafické znázornenie štruktúry enzýmu b-galaktozidázy (zdroj: Jawahar Swaminathan a MSD zamestnanci v Európskom bioinformatickom inštitúte [verejná doména] prostredníctvom Wikimedia Commons)
Grafické znázornenie štruktúry enzýmu b-galaktozidázy (zdroj: Jawahar Swaminathan a MSD zamestnanci v Európskom bioinformatickom inštitúte [verejná doména] prostredníctvom Wikimedia Commons) Najštudovanejším enzýmom je enzým openu Lak z A. coli, Kódovaný Lakz, ktorých štúdie boli kľúčom k pochopeniu fungovania genetických operátov a mnohých ich regulačných aspektov.
V súčasnosti patrí do najlepšieho uvádzanej skupiny enzýmov a ich najznámejšou funkciou je hydrolýza glukozidných väzieb laktózy. Spĺňa základné metabolické funkcie v organizmoch, ktoré ich vyjadrujú a používa sa aj s rôznymi priemyselnými účelmi.
Medzi priemyselné aplikácie patrí odstránenie laktózy mliečnych výrobkov pre ľudí neznášanlivých na laktózu a výroba niekoľkých zlúčenín galaktity. Používajú sa tiež na zlepšenie sladkosti, chuti a trávenia mnohých mliečnych výrobkov.
[TOC]
Charakteristika
Okrem substrátov galaktity, ako je laktóza, väčšina známych β-galaktozidáz vyžaduje dvojité kovové ióny, ako je horčík a sodík. Toto sa dokázalo s objavením únie miest pre tieto kovy v jej štruktúre.
Β-galaktosidas prítomné v prírode majú veľké množstvo rozsahov pH, na ktoré môžu pracovať. Plesňové enzýmy fungujú v kyslom prostredí (2.5 až 5.4), zatiaľ čo kvasinky a baktérie fungujú medzi 6 a 7 pH jednotiek.
Môže vám slúžiť: gram negatívne baktériebakteriál p-galaktosidas
Baktérie majú veľké galato-hydrolytické enzýmy v porovnaní s inými analyzovanými galaktosidami. V týchto organizmoch rovnaký enzým katalyzuje tri typy enzymatických reakcií:
- Hydrolyza laktóza na jej konštitutívne monosacharidy: galaktóza a glukóza.
- Katalyzuje transgastiláciu laktózy na alolaktózu, disacharidový cukor, ktorý sa podieľa na pozitívnej regulácii expresie génov patriacich do Opeone Lak, Odtieňovanie.
- Hydrolyzuje alolaktózu podobnú tomu, ako to robí s laktózou.
plesňové plesne
Huby majú β-galaktozidázové enzýmy náchylnejšie na inhibíciu galaktózy ako enzýmy patriace k iným organizmom. Sú však termostabilné a pracujú v rozsahu kyslých pH.
Metabolizmus laktózy sprostredkovaný týmito enzýmami v húb je rozdelený na extracelulárny a cytosolický.
Štruktúra
P-galaktozidázový enzým baktérií je tetramerický enzým (zo štyroch identických podjednotiek, A-d) a každý z jeho monomérov má viac ako 1.000 aminokyselinových odpadov, čo znamená molekulovú hmotnosť viac ako 100 kDa pre každého a viac ako 400 kDa pre komplexný proteín.
V rastlinách je naopak enzým podstatne menšia a môže sa bežne vyskytnúť ako dimér rovnakých podjednotiek.
Domény každého monoméru sa rozlišujú s číslami od 1 do 5. Doména 3 má hlavnú štruktúru a/β „čas“ a má aktívne miesto na konci hlavne C-konca valca.
Môže vám slúžiť: Organogenéza zvierat a rastlín a jej vlastnostiPredpokladá sa, že aktívne miesta enzymatického komplexu sa zdieľajú medzi monomérmi, takže tento enzým je biologicky aktívny iba vtedy, keď je komplexovaný ako tetrameter.
Jeho aktívna stránka má schopnosť pripojiť sa. Je zvlášť špecifický pre d-galaktózu, ale nie je to tak pre glukózu, takže enzým môže pôsobiť na iné galaktozidy.
Funkcia
U zvierat
V čreve ľudí sa hlavná funkcia tohto enzýmu týka s absorpciou laktózy požitej jedlom, pretože sa nachádza na luminálnej tvári plazmatickej membrány črevných buniek vo forme tvaru kefy.
Okrem toho sa ukázalo, že lyzozomálne izoformy tohto enzýmu sa zúčastňujú na degradácii mnohých glukolipidov, mukocolysacharidov a glykoproteínov galaktity, ktoré majú viaceré účely na rôznych bunkových trasách.
V rastlinách
Rastliny majú na listoch a semenách enzýmy p-galaktozidázy. Tieto plnia dôležité funkcie v katabolizme galaktolipidov, ktoré sú charakteristické pre riasy a rastliny vo všeobecnosti.
V týchto organizmoch sa β-galaktozidáza podieľa na procesoch rastu rastlín, dozrievania ovocia a v horných rastlinách je to jediný známy enzým schopný hydrolyzujúceho galaktozylového odpadu z galakonozitívnych polysacharidov bunkovej steny bunkovej steny.
V priemysle a výskume
V potravinárskom priemysle súvisiaci s mliečnymi výrobkami sa enzým p-galaktozidázy používa na katalyzáciu hydrolýzy laktózy prítomnej v mliečnych výrobkoch, ktoré sú zodpovedné za mnohé z defektov súvisiacich s skladovaním týchto výrobkov.
Hydrolýza tohto cukru sa snaží vyhnúť sedimentácii častíc, kryštalizácii mrazených mliečnych dezertov a prítomnosti „piesočnatých“ textúr vo väčšine komerčných derivátov mlieka.
Môže vám slúžiť: Zemský potravinový reťazec: Odkazy a príkladΒ-galaktozidáza, ktorá sa používa priemyselne, sa získava bežne z húby Aspergillus spona., Aj keď enzým produkovaný kvasinkami Kluyveromyces lactis Je tiež široko používaný.
Aktivita β-galaktozidázy, ktorá sa premieta do vedeckých pojmov, ako je „fermentácia laktózy“, sa bežne testuje na identifikáciu gramne negatívnych enterobaktérií prítomných v rôznych typoch vzoriek.
Okrem toho sa z lekárskeho hľadiska používa na výrobu mliečnych výrobkov bez laktózy a na formuláciu tabliet používaných ľuďmi neznášanlivými na laktózu na trávenie mlieka a ich derivátov (jogurt, syr, zmrzlinu, maslo, krémy atď.).
Používa sa ako „biosenzory“ alebo „biomarker“ s diverzitou účelov, od imunotestov a toxikologickej analýzy až po analýzu génovej expresie a diagnostiky patológií vďaka chemickej imobilizácii tohto enzýmu v osobitných podpora.
Odkazy
- Henrissat, B., & Daviest, G. (1997). Klasifikácia glykozidov hydrolov založená na štrukturálnej a sekvencii. Súčasná biológia, 7, 637-644.
- Huber, r. (2001). Beta (b) -galaktozidáza. Akademická tlač, 212-214.
- Husain, Q. (2010). β Galactosidaese a ich potenciálne aplikácie: prehľad. Kritické prehľady v biotechnológii, 30, 41-62.
- Sudca D. H., Matthews, b. W., & Huber, R. A. (2012). LACZ B-GALAKTOSIDASE: Štruktúra a funkcia enzýmu historického a molekulárneho biologického významu. Vedecký proteín, dvadsaťjeden, 1792-1807.
- Lee, b. A., Han, J. Do., Im, J. Siež., Morrone, a., Johung, K., Goodwin, C.,... hwang a. Siež. (2006). Β -galaktozidáza s starnutím je lyzozomálna β -gastozidáza. Starnúca bunka, 5, 187-195.
- Matthews, b. W. (2005). Štruktúra E. p-galaktozidáza coli. C. R. Biológia, 328, 549-556.
- McCarter, J. D., & Withers, s. G. (1994). Mechanizmy enzymatickej hydrolýzy glykozidov. Súčasný názor na štrukturálnu biológiu, 4, 885-892.
- Richmond, m., Gray, J., & Stine, C. (1981). Beta-galaktozidáza: Preskúmanie nedávnej súvislosti s technologickým uplatňovaním, výživovými obavami a imobilizáciou. J Dairy Sci, 64, 1759-1771.
- Wallenfels, K., & Weil, r. (1972). B-galaktozidáza.

