História berylia, štruktúra, vlastnosti, použitia

- 2119
- 137
- Ing. Ervín Petruška
On berýlium Je to kovový prvok, ktorý patrí do skupiny 2 alebo IIA periodickej tabuľky. Je to najľahší alkalický kov v skupine a je reprezentovaný symbolom BE. Jeho atóm a katión sú tiež menšie ako atmosféry ich rovesníkov (Mg, CA, MR ...).
Kvôli svojej neobvyklej hustote zaťaženia sa tento kov zvyčajne nevyskytuje izolovane. Poznajú asi 30 minerálov, ktoré ho obsahujú, medzi ktorými patrí: beryl (3beo · al2Ani3· 62· 2h2O), Bertrandita (4beo.2Se2.2h2O), El Chrisoberilo (Beal2Ani4) a fenaquita (byť2Jo4).
 Kovové beryll pipity. Zdroj: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Kovové beryll pipity. Zdroj: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] La Esmeralda, drahý kameň, je variant Beryl. Čisté berylia však nie je také pozoruhodné; Vyzerá bledošedý jas (vynikajúci obraz) a bol dosiahnutý vo forme Pepitas alebo Dragees.
Berylium má súbor charakteristických fyzikálnych vlastností. Má nízku hustotu; vysoké tepelné a elektrické správanie, ako aj jeho tepelná kapacita a rozptyl tepla; Nie je to magnetický kov; a má tiež vhodnú kombináciu tuhosti a elasticity.
Všetky tieto vlastnosti viedli k tomu, že Berylium bol kov s mnohými aplikáciami, od jeho používania v zliatinách medi na vypracovanie nástrojov, až po jeho použitie v raketách, lietadlách, autách, jadrových reaktoroch, zariadeniach X -Bay, rezonančný jadrový magnetický atď. .
Berylium má 10 známych izotopov, od odchodov 5Byť 14Byť, byť 9Byť jedinou stajňou. Je to tiež veľmi toxický kov, ktorý ovplyvňuje najmä dýchací systém, takže v jeho používaní existuje obmedzenie.
[TOC]
História vášho objavu
Berylium objavil Louis-Nicolas Vauguelin v roku 1798 ako kompozičný prvok minerálu Berilo a kremičitanu z hliníka a berylia.
Následne sa nemeckému chemikovi Frederic Wöhler v roku 1828 podarilo izolovať berylia reagovaním draslíka s beryliovým chloridom v platinovom hrnci.
Súčasne a nezávisle francúzsky chemik Antoine Bussy tiež dosiahol izoláciu berylia. Wöhler bol prvý, kto navrhol názov Berylia pre kov.
V roku 1957 dostal svoje súčasné meno, pretože bol predtým známy ako glucinium kvôli sladkej chuti niektorých solí. Ale aby sa predišlo zámene s inými zlúčeninami sladkej chuti a s rastlinou zvanou Glucina sa rozhodlo zmeniť názov pre berylium.
Berily
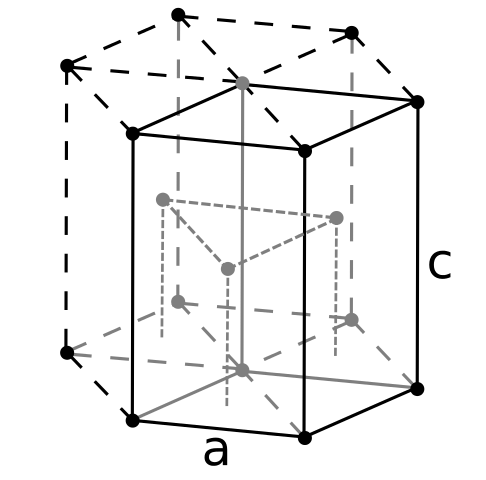 Berily Criggn Structure. Zdroj: Používateľ: Dornelf [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Berily Criggn Structure. Zdroj: Používateľ: Dornelf [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Byť beryl najľahší z alkalinoteróznych kovov, malo by sa očakávať, že objem jeho atómov bude najmenší zo všetkých. Atómy berylilu interagujú navzájom cez kovovú väzbu, takže ich „more elektrónov“ a odpor medzi jadrami modelujú výslednú sklenenú štruktúru.
Môže vám slúžiť: kyselina periódová (HIO4): Čo je, štruktúra, vlastnosti, použitiaPotom sa vytvoria čierne kryštály berylia. Tieto kryštály majú šesťuholníkovú štruktúru (vynikajúci obraz), kde každý má šesť bočných susedov a tri ďalšie v horných a nadolových rovinách.
Byť čiernymi kryštálmi je to užitočné. Toto je jedna z najkompaktnejších štruktúr, ktorú môže kov prijať; A dáva zmysel, že také malé atómy „stláčania“, aby sa predišlo najmenšiemu množstvu prázdnoty alebo počtu dier medzi nimi.
Elektronická konfigurácia
1s22s2
Čo sa rovná 4 elektrónom, z ktorých 2 sú z Valencie. Ak sa propaguje elektrón na orbitáli 2p, budú mať dve orbitály SP Hbíbridos. V zlúčeninách berýlium teda môžu byť lineárne geometrie, X-BE-X; Napríklad izolovaná molekula Becl2, Cl-cl.
Vlastnosti
Fyzický popis
Mastná šedá, jasná a krehká farba.
Bod topenia
1287 ° C.
Bod varu
2471 ° C.
Hustota
- 1 848 g/cm3 pri izbovej teplote.
- 1,69 g/cm3 do bodu topenia (stav kvapalného).
Atómové rádio
232 PM.
Kovalentný rádio
210 hod.
Atómový objem
5 cm3/mol.
Špecifické teplo
1 824 j/g · mol pri 20 ° C.
Fúzne teplo
12,21 kJ/mol.
Odparovacie teplo
309 kJ/mol.
Elektronegativita
1,57 v Paulingovej stupnici.
Štandardný potenciál
1,70 V.
Rýchlosť zvuku
12.890 m/s.
Tepelná rozťažnosť
11,3 um/m · K pri 25 ° C.
Tepelná vodivosť
200 w/m · k.
Chemické vlastnosti
Berylium je pokryté vrstvou oxidu beryl (včela), ktorá slúži ako ochrana vzduchu pri izbovej teplote. Oxidácia berylia sa vyskytuje pri teplotách vyšších ako 1 000 ° C, pôvodom ako oxid berylium a produkty nitridu berylia.
Je tiež odolný voči pôsobeniu kyseliny dusičnej 15 m. Ale rozpúšťa sa v kyseline chlorovodíkovej a alkalis, ako je hydroxid sodný.
Žiadosti
Príprava nástrojov
Berylium tvorí zliatiny s meďou, niklom a hliníkom. Najmä zliatina s meďou vytvára nástroje veľkej tvrdosti a odolnosti, ktoré tvoria iba 2% hmotnosti zliatiny.
Tieto nástroje nevyrábajú iskry pri zasiahnutí železa, čo im umožňuje použitie v prostrediach s vysokým obsahom horľavých plynov.
Môže vám slúžiť: tepelná: štruktúra, charakteristiky, formovanie, príkladyVďaka svojej nízkej hustote má ľahkú hmotnosť, ktorá spolu s jeho tuhosťou umožňuje jeho použitie v vesmírnych lietadlách, raketách, raketách a lietadlách. Zliatina s beryliom sa používa pri vypracovaní častí automobilov. Používa sa tiež v rozpracovaní Springs.
Vzhľadom na veľkú tvrdosť, ktorú udelil Beryllium jeho zliatine, sa použili v brzdach vojenských lietadiel.
Vypracovanie zrkadiel
Berylium sa používa pri výrobe zrkadiel kvôli svojej rozmerovej stabilite a schopnosti mať vysoký pulter. Tieto zrkadlá sa používajú v satelitoch a systémoch riadenia požiaru. Okrem toho sa používajú vesmírne teleskopy.
V ionizujúcom žiarení
Berylium je prvok s nízkou hustotou, takže sa dá považovať za priehľadný pre x -rias. Táto funkcia umožňuje jeho použitie pri konštrukcii okien trubíc, ktoré produkujú X -Rays, priemyselnú aplikáciu a lekársku diagnostiku.
Podobne sa v oknách rádioaktívnych emisných detektorov používa berylium.
V tímoch generujúcich magnetizmus
Medzi charakteristikami berylia nie je magnetický prvok. To umožňuje jeho použitie pri konštrukcii článkov magnetických rezonančných zariadení, v ktorých sa vytvárajú magnetické polia veľkej intenzity, čo minimalizuje akékoľvek rušenie.
Jadrová reaktory
Vďaka svojmu vysokému fúznemu bodu našiel aplikáciu v jadrových reaktoroch a keramike. Berylium sa používa ako moderátor jadrových reakcií a ako výrobca neutrónov:
9Byť + 4On (α) => 12C +N (neutrón)
Odhaduje sa, že pre milión atómov beryl, ktoré sú bombardované a časticami, sa vyskytuje až 30 miliónov neutrónov. Presne táto jadrová reakcia umožnila objavenie neutrónov.
James Chadwick bombardoval atómy berylia s časticami a). Výskumník pozoroval uvoľňovanie sumátomických častíc bez elektrického náboja, čo viedlo k objavu neutrónov.
Chránič kovu
Pridajte množstvo berylium na povrch kovov, ktoré je možné oxidovať, poskytuje určitú ochranu. Napríklad horlosť horčíka je znížená a jas zliatin striebra je predĺžená.
Kde sa to nachádza?
Beryl sa nachádza v pegmatite, ktorý je spojený s sľudom, živým a kremeňom. Použitím flotačnej techniky je možné oddeliť zmes beryl a živca. Následne sa živce a beryl koncentrujú a podrobia sa liečbe chlórnanom vápenatého.
Môže vám slúžiť: rozdiely medzi organickými a anorganickými zlúčeninamiNasleduje ošetrenie kyselinou sírovou a sulfonátom draselného z riedenia, dosiahne sa flotácia beryl a oddeľuje ju od živca.
Beryl je ošetrený sodným fluorosylikátom a sódou pri 770 ° C, aby sa vytvoril fluoroboberát sodný, oxid hlinitý a oxid kremíka. Potom sa vyzráža hydroxid hydroxidu hydroxidu sodného hydroxidu sodného.
Fluorid berylium sa tvorí reakciou beryl hydroxidu s amoniakálnym fluoridom vodíka, ktorý produkuje amónny amónny amónny. Toto je zahrievané na vytvorenie fluoridu berylia, ktorý je ošetrený horúcim horčíkom na izoláciu berylia.
Riziká
Berylia ako jemne rozdelený kov vo forme roztokov, suchého prachu alebo dymu je veľmi toxický a môže produkovať dermatitídu. Najväčšia toxicita sa však vytvára inhaláciou.
Spočiatku môže berylium vyvolať precitlivenosť alebo alergiu, ktorá sa môže stať beliózou alebo chronickým ochorením berylia (CBD). Toto je závažné ochorenie, ktoré sa vyznačuje poklesom kapacity pľúc.
Akútne ochorenie je zriedkavé. Pri chronických ochoreniach je v tele tvorba farulomu, najmä v pľúcach. Chronická belióza spôsobuje progresívnu dýchavičnosť, kašeľ a všeobecnú slabosť (asténia).
Akútna belióza môže byť smrtiaca. Pri belióze dochádza k progresívnej strate dýchacích funkcií, pretože dochádza k obštrukcii prietoku dýchacích ciest v dýchacích cestách a znížené okysličovanie krvného tlaku v krvi krvi.
Odkazy
- Kráľovská spoločnosť chémie. (2019). Berýlium. Získané z: RSC.orgán
- Národné centrum pre biotechnologické informácie. (2019). Berýlium. Databáza pubchem. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- HelMestine, Anne Marie, PH.D. (15. marca 2019). Fakty berýlia. Zotavené z: Thoughtco.com
- Wikipedia. (2019). Berýlium. Zdroj: In.Wikipedia.orgán
- Šošovica B. Vložka. (2019). Beryllium-be. Získané z: Lentech.com
- Materiál spoločnosti. (2019). Dozviete sa viac o prvku berylia získané z: beryllium.com
- D. Michaud. (12. apríla 2016). Problém so spracovaním a extrakciou berylia. 911 metalurgista. Získané z: 911Metallurgist.com
- Timothe P. Hanusa. (5. januára 2016). Berýlium. Encyclopædia Britannica. Získané z: Britannica.com
- Čítanie s. Nový človek. (2014). Berylium ochorenie. Manuál MSD. Získané z: MSDManuals.com
- « História športovej psychológie, ciele a profily
- Sociálna globalizácia Sociálna dimenzia, výhody a príklady »

