Anhydridy

- 4238
- 944
- Gabriel Bahna
Čo sú anhydridy?
Ten Anhydridy Sú to chemické zlúčeniny, ktoré pochádzajú zo spojenia dvoch molekúl oslobodením vody. Dalo by sa to považovať za dehydratáciu počiatočných látok; Aj keď to nie je presne pravda.
V organickej a anorganickej chémii sa spomínajú a v oboch vetvách sa ich porozumenie do značnej miery líši. Napríklad v anorganickej chémii sa považuje za základné a oxidy kyselín, ako sú netkania ich hydroxidov a kyselín, pretože prvá reagovala s vodou za vzniku druhého.
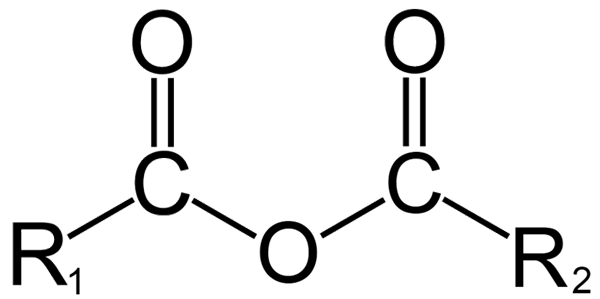 Všeobecná štruktúra anhydridov. Zdroj: Dremmetbrownie [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)], z Wikimedia Commons
Všeobecná štruktúra anhydridov. Zdroj: Dremmetbrownie [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)], z Wikimedia Commons Tu je možné vygenerovať zámenu medzi výrazmi „bezvodý“ a „anhydrido“. Všeobecne sa bezvodie vzťahuje na zlúčeninu, na ktorú bola dehydratovaná bez zmien v jej chemickom charaktere (neexistuje žiadna reakcia); Zatiaľ čo s anhydridom dochádza k chemickej zmene, ktorá sa odráža v molekulárnej štruktúre.
Ak sa porovnávajú zodpovedajúce hydroxidy a kyseliny (alebo anhydridy), bude pozorované, že došlo k reakcii. Na druhej strane, niektoré oxidy alebo soli môžu byť hydratované, strácajú vodu a naďalej sú rovnakými zlúčeninami; Ale bez vody to znamená anhydros.
Na druhej strane v organickej chémii je pôvodná definícia chápaná anhydridom. Napríklad jednou z najznámejších anhydridov sú tie odvodené z karboxylových kyselín (vynikajúci obraz). Pozostávajú z spojenia dvoch acylových skupín (-RCO) prostredníctvom atómu kyslíka.
Vo svojej všeobecnej štruktúre je uvedený R1 Pre skupinu acyl a r2 Pre druhú skupinu Acilo. Pretože r1 a r2 Sú odlišné, pochádzajú z rôznych karboxylových kyselín a potom je to anhydrid kyseliny asymetrovej. Keď sú oba substituenty r (či už aromatické) rovnaké, v tomto prípade sa hovorí v tomto prípade anhydridu kyseliny symmetrovej.
V čase prepojenia dvoch karboxylových kyselín na vytvorenie anhydridu sa môže alebo nevytvára voda, ako aj ďalšie zlúčeniny. Všetko bude závisieť od štruktúry týchto kyselín.
Nehnuteľnosti
Vlastnosti anhydridov budú závisieť od toho, na ktoré sa odvoláva. Takmer každý má spoločné, že reagujú s vodou. Avšak pre takzvané základné anhydridy v anorganickom je niekoľko z nich dokonca nerozpustné vo vode (MGO), takže toto vyhlásenie sa zameria na anhydridy karboxylových kyselín.
Body fúzie a varu padajú na molekulárnu štruktúru a intermolekulárne interakcie pre (RCO)2Alebo, toto je všeobecný chemický vzorec týchto organických zlúčenín.
Ak molekulárna hmotnosť (RCO)2Alebo je nízka, pravdepodobne je to bezfarebná kvapalina pri teplote a tlaku miestnosti. Napríklad anhydrid octov (alebo Ehydridge3Co)2Alebo je to tekutý a najdôležitejší priemyselný význam, jeho výroba je veľmi rozsiahla.
Reakcia medzi anhydridom octovej a vodou predstavuje nasledujúcu chemickú rovnicu:
(Ch3Co)2Alebo + h2O => 2ch3Kohútik
Všimnite si, že keď sa pridá molekula vody, uvoľňujú sa dve molekuly kyseliny octovej. Reverzná reakcia sa však nemôže vyskytnúť pre kyselinu octovú:
Môže vám slúžiť: rovnováha kvapaliny-vapor2c3COOH => (CHO3Co)2Alebo + h2Alebo (nestane sa)
Je potrebné uchýliť sa k inej syntetickej trase. Na druhej strane dikarboxylové kyseliny to môžu urobiť zahrievaním; Ale bude to vysvetlené v nasledujúcej časti.
Chemické reakcie
Hydrolýza
Jednou z najjednoduchších reakcií anhydridov je ich hydrolýza, ktorá sa práve ukázala pre anhydrid octovej. Okrem tohto príkladu existuje anhydrid kyseliny sírovej:
H2Siež2Ani7 + H2Alebo 2h2SW4
Tu máte anhydrid kyseliny anorganovej. Všimnite si, že pre h2Siež2Ani7 (tiež nazývaná kyselina disulfurová), reakcia je reverzibilná, takže zahrievanie h2SW4 Koncentrát vedie k tvorbe jeho anhydridu. Ak na druhej strane je to zriedený roztok h2SW4, Je vydaný tak3, Anhydrid.
Esterifikácia
Kyslé anhydridy reagujú s alkoholmi, s pyridínom v strede, aby vznikli esteru a karboxylovej kyseliny. Napríklad sa berie do úvahy reakcia medzi anhydridom octovej a etanolom:
(Ch3Co)2Alebo + ch3Chvály2OH => Cho3Co2Chvály2Chvály3 + Chvály3Kohútik
Tým tvorba etygetánového esteru, ch3Co2Chvály2Chvály3, a kyselina etánu (kyselina octová).
Prakticky to, čo sa stane, je nahradenie vodíka hydroxylovej skupiny skupinou Aquilus:
R1-Oh => r1-Okor2
V prípade (ch3Co)2Alebo, vaša skupina Acilo je -coch3. Preto sa hovorí, že skupina OH prechádza aciláciou. Acilácia a esterifikácia však nie sú vzájomne zameniteľné koncepty; Acilácia sa môže vyskytnúť priamo v aromatickom kruhu, známeho ako názov acilácie Friedel-Crafts.
Alkoholy v prítomnosti kyslých anhydridov sú teda esterifikované aciláciou.
Na druhej strane iba jedna z dvoch kyslých skupín reaguje s alkoholom, druhá zostáva s vodíkom tvoriacou kyselinu karboxylovú; že v prípade (Cho3Co)2Alebo je to kyselina etanovú.
Udelenie
Kyslé anhydridy reagujú s amoniakom alebo amínmi (primárnymi a sekundárnymi), aby vznikli amidami. Reakcia je veľmi podobná novo opísanej esterifikácii, ale ROH je nahradený amínom; Napríklad sekundárna Amina, r2NH.
Opäť reakcia medzi (ch3Co)2Alebo dietylamín, et2NH:
(Ch3Co)2O + 2et2Nh => ch3Kont2 + Chvály3Coo- +NH2Et2
A tvoria sa dielacetamid, cho3Kont2, a karboxylovaná amónna soľ, Cho3Coo- +NH2Et2.
Aj keď sa rovnica môže zdať trochu ťažká, stačí pozorovať, ako skupina -coch3 Vymeňte H ET2NH, aby sa vytvorila Amida:
Et2Nh => et2Nicoch3
Viac ako amidácia je reakciou stále acilácia. V tomto slove je zhrnuté všetko; Tentoraz Amina trpí aciláciou a nie alkoholom.
Ako sa majú anhydridy?
Anorganické anhydridy sa tvoria reakciou prvku kyslíkom. Ak je teda prvok kovový, vytvorí sa základný kovový oxid; A ak je nemetalický, tvorí sa nemetalický oxid alebo kyslý anhydrid.
Môže vám slúžiť: Clausius-Clapeyronova rovnica: Na čo ide, príklady, cvičeniaPre organické anhydridy je reakcia ďalšia. Dve karboxylové kyseliny sa nemôžu priamo spojiť, aby uvoľňovali vodu a tvorili kyselinu anhydrid; Účasť zlúčeniny, ktorá ešte nebola spomenutá: acylchlorid, RCOCL je potrebný.
Kyselina karboxylová reaguje s chloridom kyseliny a produkuje príslušný chlorid anhydrid a vodík:
R1COCL + R2CoOH => (r1Co) alebo (cor2) + HCl
Chvály3COCL + CH3COOH => (CHO3Co)2O + HCl
CH3 pochádza zo skupiny Acetyl, Cho3Co- a druhý už je prítomný v kyseline octovej. Výber špecifického chloridu kyseliny, ako aj kyseliny karboxylovej, môže viesť k syntéze symetrického anhydridu kyseliny asymetrovej alebo asymetrovej.
Cyklické anhydridy
Na rozdiel od ostatných karboxylových kyselín, ktoré vyžadujú chlorid kyseliny, môžu dikarboxylové kyseliny kondenzovať v zodpovedajúcom anhydridu. Na to je potrebné ich zahriať, aby podporovali uvoľňovanie H2Ani. Napríklad tvorba ftalického anhydridu je znázornená z kyseliny fotálnej kyseliny.
 Tvorba anhydridu. Zdroj: Jü [verejná doména], z Wikimedia Commons
Tvorba anhydridu. Zdroj: Jü [verejná doména], z Wikimedia Commons Všimnite si, ako sa dokončí pentagonálny krúžok a je súčasťou kyslík, ktorý sa spája s oboma skupinami C = o; Toto je cyklický anhydrid. Je tiež zrejmé, že ftalický anhydrid je symetrický anhydrid, pretože toľko r1 ako r2 Sú rovnaké: aromatický prsteň.
Nie všetky dikarboxylové kyseliny sú schopné vytvárať svoj anhydrid, pretože keď sú ich skupiny COOH veľmi oddelené, sú nútené dokončiť čoraz väčšie kruhy. Najväčší kruh, ktorý sa dá vytvoriť.
Menovanie
Ako sú pomenované anhydridy? Mená organických anhydridov, ktoré ponechávajú anorganické, relevantné pre problémy s oxidom1 a r2; to znamená z jeho acylových skupín.
Ak sú tieto dve r rovnaké, stačí nahradiť slovo „kyselina“ „anhydrid“ v príslušnom názve karboxylovej kyseliny. A ak sú naopak obidve R iné, sú pomenované v abecednom poradí. Preto, aby ste vedeli, ako to nazvať, musíte vidieť najskôr, ak je to symetrická alebo asymetrická anhydrid.
CH3Co)2Alebo je to symetrické, pretože r1= R2 = CH3. Odvodzuje z kyseliny octovej alebo etanovej, takže jej názov je podľa predchádzajúceho vysvetlenia: acetický alebo etanoický anhydrid. To isté sa deje s práve spomínanou anhydridom fthalic.
Predpokladajme, že máte nasledujúci anhydrid:
Chvály3CO (o) Coch2Chvály2Chvály2Chvály2Chvály2Chvály3
Acetylová skupina vľavo pochádza z kyseliny octovej a že vpravo, z kyseliny heptánovej. Ak chcete vymenovať túto anhydride, musíte vymenovať svoje skupiny R v abecednom poradí. Takže sa volá: heptanoický anhydrid octu.
Žiadosti
Anorganické anhydridy majú nekonečné aplikácie, zo syntézy a formulácie materiálov, keramiky, katalyzátorov, cementov, elektród, hnojív atď., Až do povlaku zemskej kôry s tisíckami železa a hliníkových minerálov a oxid uhličitý vydychovaný živými organizmami.
Môže vám slúžiť: dekantácia: koncept, príklady a typyPredstavujú počiatočný zdroj, bod, v ktorom odvodzuje mnoho zlúčenín použitých pri anorganickej syntéze. Jedným z najdôležitejších anhydridov je karbonická, co2. Je to spolu s vodou nevyhnutné pre fotosyntézu. A na priemyselnej úrovni, SO3 Je nevyhnutné, pretože sa z nej získava kyselina obžalovaná kyselina sírová.
Možno, anhydrid s viacerými aplikáciami a za to, že (pokiaľ je život), je jedným z kyseliny fosforečnej: adenozín Trypposát, lepšie známy ako ATP, prítomný v DNA a „energetická mena“ metabolizmu.
Organické anhydridy
Kyslé anhydridy reagujú acyláciou, buď na alkohol, tvoriaci ester, amín, ktorý vedie k amide alebo aromatickým kruhom.
Existujú milióny každej z týchto zlúčenín a stovky tisíc možností karboxylovej kyseliny na prípravu anhydridu; Preto drasticky rastú syntetické možnosti.
Jednou z hlavných aplikácií je teda začleniť kyslú skupinu do zlúčeniny a nahradiť jeden z atómov alebo skupín jej štruktúry.
Každý oxid má osobitne svoje vlastné aplikácie, ale vo všeobecnosti všetky reagujú podobným spôsobom. Z tohto dôvodu sa tieto typy zlúčenín používajú na modifikáciu polymérnych štruktúr a na vytváranie nových polymérov; to znamená, kopolyméry, živice, povlaky atď.
Napríklad anhydrid acetického sa používa na acetiláciu všetkých skupín celulózy OH (nižší obrázok). S tým je každá H OH nahradená acetylovou skupinou, Coch3.
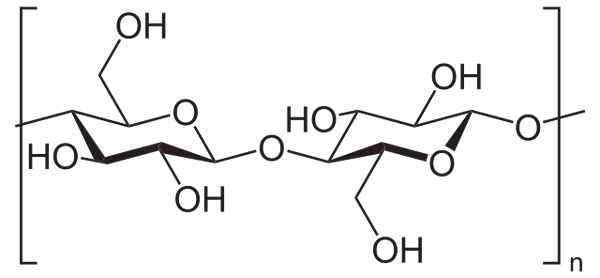 Celulóza. Zdroj: Neurotoger [verejná doména], z Wikimedia Commons
Celulóza. Zdroj: Neurotoger [verejná doména], z Wikimedia Commons Týmto spôsobom sa získa polymér octanu celulózy. Rovnaká reakcia je možné načrtnúť s inými polymérnymi štruktúrami so skupinami NH2, Tiež náchylné na aciláciu.
Tieto acilačné reakcie sú tiež užitočné pri syntéze liečiva, ako je napríklad aspirín (kyselina acetylsalicyl).
Príklady
Ukázalo sa, že dokončujú niektoré ďalšie príklady organických bezvodí. Aj keď ich nebudú spomenúť, atómy kyslíka môžu byť nahradené síry, dodávajúc sírne anhydridy alebo dokonca fosfor.
-C6H5Co (o) varí6H5: Benzoický anhydrid. Skupina C6H5 predstavuje benzénový prsteň. Jeho hydrolýza vytvára dve kyseliny benzoovej.
-HCO (o) COH: FORMICKÉ NAPLATIE. Jeho hydrolýza produkuje dve kyseliny mravčej.
- C6H5CO (o) Coch2Chvály3: Propanická benzoická anhydrid. Jeho hydrolýza produkuje kyseliny benzoických a propanínových.
-C6HjedenásťCo (o) varí6Hjedenásť: Cyklohexanokroboxylicanight anhydrid. Na rozdiel od aromatických prsteňov sú nasýtené, bez dvojitých odkazov.
-Chvály3Chvály2Chvály2CO (o) Coch2Chvály3: Propanoický butánsky anhydrid.
Sukcinický anhydrid
 Sukcinický anhydrid. Zdroj: Ninjatacoshell [verejná doména], z Wikimedia Commons
Sukcinický anhydrid. Zdroj: Ninjatacoshell [verejná doména], z Wikimedia Commons Tu máte ďalší cyklický, odvodený z kyseliny suktinovej, kyseliny dikarboxylovej. Poznámka ako tri atómy kyslíka zradia chemickú povahu tohto typu zlúčeniny.
Anhydrid maleico je veľmi podobný ako v prípade sukcinika, s rozdielom, že medzi uhlíkmi je dvojitá väzba, ktorá tvorí základňu Pentagonu.
Anhydrid
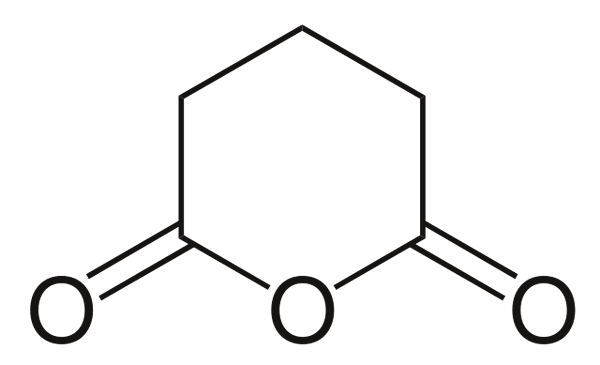 Anhydrid. Zdroj: Choij [verejná doména], z Wikimedia Commons
Anhydrid. Zdroj: Choij [verejná doména], z Wikimedia Commons A nakoniec je znázornená anhydrid kyseliny glutarovej. To štrukturálne odlišuje všetkých ostatných pozostávajúcimi z šesťuholníka. Opäť platí, že tri atómy kyslíka vynikajú v štruktúre.
Ďalšie zložitejšie anhydridy môžu vždy dokázať tri atómy kyslíka veľmi blízko seba.
Odkazy
- Anhydrid. Enclyclopaedia Britannica. Získané z: Britannica.com
- Definícia anhydridu kyseliny v chémii. Zotavené z: Thoughtco.com

