Alilo Alilic Unit, karbocation, radikálne, príklady

- 2298
- 392
- Adrián Fajnor
On Alilo alebo 2-prison je organická skupina alebo substituent, ktorej štrukturálny vzorec je Cho2= CH-CH2-. Skladá sa z vinylového fragmentu, ch2= CH- a metylénová skupina, -ch2-. Skladá sa zo skupiny alkenile, konkrétne odvodenej z propeno, Cho2= CH-CH3.
Termín „Alilo“ je spôsobený botanickým názvom, ktorý sa používa na odvolávanie sa na cesnak: Allium sativum, ktorého oleje v roku 1892 boli izolované, dial disulfidu zlúčeniny, h2C = chch2Sýt2Chrk2, zodpovedný v časti svojich charakteristických zápachov. V skutočnosti sa mnoho alilických zlúčenín, tí, ktorí majú skupinu Alilo, sa nachádzajú v cesnaku a zelenine.
 Alilo
Alilo Horný obrázok ukazuje kostrový vzorec skupiny Alilo. Okrem sinuosity napravo máme zvyšok molekuly; Ak je to alquilica, bude to znázornené symbolom R.
Je ľahké rozpoznať Alilo, pretože to vyzerá podobne ako vinylová skupina. Alilo však môže byť tiež cyklické, v zlúčeninách, ako sú Cyclops, zostane bez povšimnutia.
Príkladom alylovej zlúčeniny je spojenec alkohol, h2C = chch2Oh. Hydogény vinylového fragmentu môžu byť vymenené a zostať alilo. Teda 3-metyl-2-but-1-ol, (Cho3)2C = chch2Och, je to tiež allyický alkohol. Preto je možná existencia cyklických alilí.
[TOC]
Alyická jednotka a jej časti
Dôležitejšie ako skupina Alilo, je to alyická jednotka, ktorá je rovnaká pre všetky allické zlúčeniny. Toto je: C = C-C. Koniec c = c zodpovedá vinylovým uhlíkom. Všetky atómy spojené s týmito dvoma uhlím dostanú tiež názov vinylových substituentov. Napríklad, ak sú to hydrogény, Cho2= Ch, hovoríme o vinylových hydrogénoch.
Na druhej strane, extrémny -C zodpovedá alianke. Všetky atómy alebo skupiny spojené s týmto uhlíkom sa budú nazývať Allic Substituents. Preto sú alyické zlúčeniny presne všetci, ktorí majú funkčnú skupinu (OH, S, F, COOH atď.) Alyický uhlík spojený.
Môže vám slúžiť: citrát sodný (C6H5O7NA3): Štruktúra, použitie, vlastnostiVinylové uhlíky majú hybridizáciu SP2, Takže sú viac elektronegatívni ako alyický uhlík, SPO3. Tento rozdiel v elektronickejpativite zvyšuje kyslosť alyických vodíkov, pričom tvorba alyického karbanionu je pravdepodobná. Ale ziskovejšie z hľadiska organickej syntézy je to alylová karbocation, ktorá bude vysvetlená nižšie.
Karbocation
Rezonančné štruktúry
 Alyické rezonančné štruktúry. Zdroj: rozpustenie/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)
Alyické rezonančné štruktúry. Zdroj: rozpustenie/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0) Na hornom obrázku je zobrazené spojenecké karbocation. Všimnite si, že kladné zaťaženie (+) sa objaví ako prvé na Allic Carbon. Okamžite sa však k tomuto zaťaženia priťahujú elektróny s dvojitým väzbám, takže sa budú pohybovať v smere atómu alyského uhlíka aly.
V dôsledku toho máme dve rezonančné štruktúry (vľavo od obrázka). Teraz sa kladné zaťaženie nachádza na jednom z vinylových uhlíkov. Elektróny dvojitého zväzku allickej strany budú opäť priťahované kladným zaťažením a vrátia sa do svojej pôvodnej polohy. Toto sa opakuje znova a znova, pri nepredstaviteľných rýchlostiach.
Výsledok: kladné zaťaženie, +1, sa premiestni alebo rozptýli medzi tromi atómami allickej jednotky; ale sústredenie sa iba na dva uhlíky koncov. Jeden z vinylových uhlíkov si teda zachováva zaťaženie 1/2 +, zatiaľ čo Allyl Carbon zostáva s druhou polovicou záťaže a pridáva +1.
Vhodný spôsob, ako reprezentovať alyické karbocation, je prostredníctvom jeho rezonančnej hybridu (vpravo od obrázka). Preto sa pozoruje, že kladné zaťaženie je distribuované v celej jednotke ALIC.
Môže vám slúžiť: chlorid hliníka (ALCL3)Stabilita kladného zaťaženia
Demokácia pozitívneho zaťaženia poskytuje stabilitu alyické karbocation. Je to natoľko, že sa rovná sekundárnej karbocation, pokiaľ ide o stabilitu.
Na obrázku, pretože je to iba jednotka Alllic, predpokladá sa, že rozdelenie kladného zaťaženia je ekvivalentné obom uhlíkom (+1/2 pre každú). Ale to sa nesplní pre všetky aliarske zlúčeniny. Bude teda viac či menej pozitívne karbocations; čo znamená, že budú viac -menej reaktívne.
Zoberme si napríklad katión Alilo:
H2C = CH-CH2+ ↔ h2C+-Chrk2
Dve rezonančné štruktúry sú ekvivalentné distribúciou kladného zaťaženia. S katiónom 1.1-dimetylil sa však nestane rovnako:
H2C = CH-C+(Ch3)2 ↔ h2C+-Ch = c (ch3)2
V štruktúre ľavej strany je pozitívne zaťaženie stabilizované viac prítomnosťou dvoch metylových skupín, ktoré darujú časť ich negatívnej hustoty uhlíka spojenca.
Medzitým vinylové hydrogény nič neprispievajú k pozitívnemu zaťaženiu vinylového uhlíka. Štruktúra ľavice preto viac prispieva k rezonančnému hybridu tohto alyického katiónu.
Je nevyhnutné mať na pamäti, že sú to rezonančné hybridy, ktoré sú najbližšie k skutočnému stavu týchto karbocacií, a nie ich štruktúrami osobitne.
Radikálny
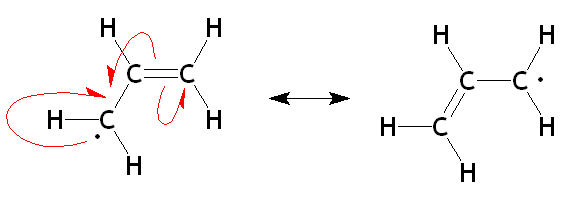 Alilo radikálne rezonančné štruktúry. Zdroj: OrganAute/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)
Alilo radikálne rezonančné štruktúry. Zdroj: OrganAute/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) Na hornom obrázku sú teraz zobrazené dve rezonančné štruktúry alyického radikálu vo svojej príslušnej alylovej jednotke. Všimnite si, že povaha jeho vývoja je rovnaká ako v prípade karbocation: Zmiznutý elektrón (·) je demokalizovaný medzi dvoma uhlíkmi koncov. Preto bude mať každý „elektrónový médium“ (1/2 ·).
Môže vám slúžiť: katión: školenie, rozdiely s aniónom a príkladmiTo, čo sa vysvetľuje pre karbocation a radikálne alilické, sa vzťahuje aj na jeho príslušný karbanion, kde každý z dvoch uvedených uhlíkových atómov bude mať polovičné záporné zaťaženie (-1/2).
Príklady alilic zlúčeniny
Uvádzajú sa na dokončenie niekoľkých príkladov alilic zlúčenín. V každom z nich bude prítomná aliarska jednotka:
-Alilo chlorid, h2C = CH-CH2-Cl
-Alyický metylsulfid, h2C = CH-CH2-S-C-CH3 (Ďalšie zlúčeniny zodpovedné za vôňu cesnaku)
-Alicina, h2C = CH-CH2-S (o) -S -ch -ch2-Chrk2
-Crotililic alkohol, Cho3CH = CH --ch2OH (všimnite si, že jeden z vinylových hydrogénov je nahradený metylom)
-Alilo acetát, h2C = CH-CH2-OC (o) ch3
-Alilo Bromid, h2C = CH-CH2-Br
-Alilamina, h2C = CH-CH2-NH2 (Základná jednotka pre zložitejšie alilamíny, ktoré sa používajú ako anti -fungicídy)
-Dimetylalil pyrofosfát, (ch3)2C = CH-CH2-Opo2-O-po3
V ďalšom páre alilamínov, flunarizínu a naftifínu, obidve s farmakologickými účinkami, môžeme oceniť skupinu Alilo:
 Štrukturálne vzorce dvoch alilamínov. Zdroj: HBF878 / CC0.
Štrukturálne vzorce dvoch alilamínov. Zdroj: HBF878 / CC0. V obidvoch je vpravo: táto dvojitá väzba podaná medzi kruhmi piperazínu (šesťuholník s dvoma atómami dusíka) a benzén. Všimnite si, že na identifikáciu alila je to nevyhnutné.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10. vydanie.). Wiley Plus.
- Wikipedia. (2020). Alyl. Zdroj: In.Wikipedia.orgán
- Elsevier B.Vložka. (2020). Alyl zlúčenina. Vedecký. Zdroj: ScienceDirect.com
- Gamini Gunawardena. (5. júna 2019). Alylový uhlík. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- « Charakteristiky historických nákladov, výhody, nevýhody, príklady
- Koncepcia krížových referencií, funkcie, príklady »

