Jód, vlastnosti, štruktúra, získanie, riziká, použitie

- 2108
- 645
- JUDr. Rudolf Čapkovič
On jód Je to reaktívny nemetalický prvok, ktorý patrí do skupiny 17 periodickej tabuľky (halogény) a je reprezentovaný chemickým symbolom I. V podstate je to dobre známy prvok na populárnej úrovni, od jodizovanej vody, po tyrozínový hormón.
V tuhom stave je jód tmavo šedý s kovovým leskom (spodný obrázok), ktorý je schopný sublimovať, aby sa vytvorila fialová pary, ktorá pri kondenzácii na studenom povrchu zanecháva tmavý zvyšok. Mnohé a atraktívne boli experimenty na demonštráciu týchto charakteristík.
 Robustné kryštály jódu. Zdroj: Bungee [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Robustné kryštály jódu. Zdroj: Bungee [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Tento prvok bol prvýkrát izolovaný Bernardom Curtoisom v roku 1811, pričom získal zlúčeniny, ktoré slúžili ako surovina na výrobu soľného. Curtois však neidentifikoval jód ako prvok, zásluhy zdieľané Joseph Gay-Lussac a Humphry Davy. Gay-Lussac identifikoval prvok ako „iode“, termín, ktorý pochádza z gréckeho slova „ioides“, s ktorým bola označená fialová farba.
Elementárny jód, rovnako ako ostatné halogény, je diatomická molekula tvorená dvoma atómami jódu spojených kovalentnou väzbou. Interakcia van der Waals medzi molekulami jódu je najsilnejšia medzi halogénmi. To vysvetľuje, prečo je jód halogénu s najvyššími bodmi topenia a varu. Okrem toho je to najmenej činidlo halogénov a ten s menšou elektronegativitou.
Jód je nevyhnutným prvkom, ktorý si vyžaduje požitie, pretože je potrebný na rast tela; mozog a mentálny vývoj; Metabolizmus všeobecne, atď., Odporúčanie denného príjmu 110 µg/deň.
Nedostatok jódu v stave plodu človeka je spojený s výskytom kritinizmu, čo je stav charakterizovaný spomaľovaním rastu tela; ako aj nedostatočný duševný a intelektuálny rozvoj, strabizmus atď.
Medzitým je nedostatok jódu v akomkoľvek veku jednotlivca spojený s výskytom strunu, ktorá sa vyznačuje hypertrofiou štítnej žľazy. Strana je endemická choroba, pretože je obmedzená na určité geografické oblasti s vlastnými potravinovými charakteristikami.
[TOC]
História
Objavenie
Jód objavil francúzsky chemik Bernard Curtois v roku 1811, keď pracoval so svojím otcom pri výrobe Salitra, ktorý si vyžaduje uhličitan sodný.
Táto zlúčenina bola izolovaná od morských rias, ktoré sa zbierali na pobreží Normandie a Bretónska. Za týmto účelom riasy spálili a popol sa premyli vodou, čím zničili výsledný odpad pridaním kyseliny sírovej.
Pri jednej príležitosti, možno kvôli náhodnej chybe, Curtois pridal prebytok kyseliny sírovej a fialovú paru, ktorá kryštalizovala na studených povrchoch a ukladala ako tmavé kryštály. Curtois mal podozrenie, že bol v prítomnosti nového prvku a nazval ho „látkou X“.
Curtois zistil, že táto látka, keď sa zmieša s amoniakom.
Curtois však mal obmedzenia na pokračovanie vo svojom výskume a rozhodol sa dodať príznaky svojej látky Charlesovi Desormesovi, Nicolasovi Clémentovi, Josephovi Gay-Lussacovi a André-Marie Ampère, aby získal spoluprácu.
Vznik mena
V novembri 1813 Desormes a Clément zverejnili objav Curtois. V decembri toho istého roku Gay-Lussac uviedol, že nová látka by mohla byť novým prvkom, ktorý naznačuje meno „iode“ z gréckeho slova „Ioides“, určené pre Violet.
Sir Humphry Davy, ktorý dostal časť vzorky dodanej do Ampère Curtois, uskutočnil experimenty so vzorkou a všimol si podobnosť s chlórom. V decembri 1813 sa Royal Society of London zúčastnila identifikácie nového prvku.
Aj keď argument medzi gay-Lussac a Davy o identifikácii jódu, obaja uznali, že Curtois bol prvý, kto ho izoloval. V roku 1839 finále Curtois.
Historické použitie
V roku 1839 Louis Daguerre dal jódovi prvé komerčné použitie vynálezom metódy na výrobu fotografických obrazov nazývaných daguerreotypy, v tenkých listoch kovu.
V roku 1905 americký patológ David Marine skúmal nedostatok jódu pri určitých chorobách a odporučil jeho príjem.
Fyzikálne a chemické vlastnosti
Vzhľad
 Sublimácia jódových kryštálov. Zdroj: Ershova Elizaveta [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Sublimácia jódových kryštálov. Zdroj: Ershova Elizaveta [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Tmavošedý kovový lesk. Keď sublimuje jeho výpary, sú fialové sfarbenie (vynikajúci obrázok).
Štandardná hmotnosť
126 904 u
Atómové číslo (z)
53
Bod topenia
113,7 ° C
Bod varu
184,3 ° C
Hustota
Okolitá teplota: 4 933 g/cm3
Rozpustnosť
Vo vode sa rozpúšťa, aby spôsobil hnedé roztoky koncentrácie 0,03% až 20 ° C.
Táto rozpustnosť sa značne zvyšuje, ak existujú predtým rozpustené jodidové ióny, pretože sa stanoví rovnováha medzi I- a ja2 Na vytvorenie aniónového druhu i3-, čo je vyriešené lepšie ako jód.
V organických rozpúšťadlách, ako je chloroforma, uhlíkový tetrachlorid a disulfid uhlíka, sa jód rozpúšťa a dáva fialové sfarbenie. Tiež sa rozpúšťa v zlúčeninách dusíka, ako je pyridín, chinolín a amoniak, a znova tvoria hnedý roztok.
Rozdiel v sfarbeniach spočíva v tom, že jód sa rozpustí ako solvatované molekuly i2, alebo ako komplexy zaťaženia; Ten sa objaví, keď sa vysporiadajú.
Môže vám slúžiť: sulfid sodný (NA2S)Vôňa
Aker, dráždivý a charakteristický. Prah zápachu: 90 mg/m3 a prah podráždenia vône: 20 mg/m3.
Koeficient priečneho októbra/vody
Log p = 2,49
Rozklad
Keď je zahrievaný na rozklad, emituje dym z vodíka a niekoľko zlúčenín jodidov.
Hrebeň
2,27 CP pri 116 ° C
Trojitý bod
386,65 K a 121 kPa
Kritický bod
819 K a 11,7 MPa
Fúzne teplo
15,52 kJ/mol
Odparovanie
41,57 kj/mol
Molárna kalikára
54,44 J/(mol · k)
Tlak vodnej pary
Jód má mierny tlak pary a keď sa otvorí nádoba, ktorá obsahuje, pomaly sa sublimuje do fialovej pary, dráždi očami, nosom a hrdlom.
Oxidácia
Oxidačné čísla pre jód sú: -1 (i-), +1 (i+), +3 (i3+), +4 (i4+), +5 (i5+), +6 (i6+) a +7 (i7+). Vo všetkých jodidových soli, ako je v prípade KI, jód spĺňa oxidačné číslo -1, pretože máme anión i-.
Jód získa kladné oxidačné čísla, keď je kombinovaný s viac elektronegatívnymi prvkami ako on; Napríklad v ich oxidoch (i2Ani5 a ja4Ani9) alebo interhalogénne zlúčeniny (I-F, I-Cl a I-BR).
Elektronegativita
2,66 v Paulingovej stupnici
Ionizačná energia
Prvé: 1.008,4 kJ/mol
Po druhé: 1.845 kj/mol
Tretie: 3.180 kJ/mol
Tepelná vodivosť
0,449 w/(m · k)
Elektrický odpor
1,39 · 107 Ω · m až 0 ° C
Magnetický poriadok
Diamagnetický
Reaktivita
Jód je kombinovaný s väčšinou kovov za vzniku jodidov a tiež s nemetalickými prvkami, ako je fosfor a ďalšie halogény. Jodidový ión je silné redukčné činidlo, ktoré spontánne uvoľňuje elektrón. Oxidácia jodidu produkuje hnedasté farbivo jódu.
Jód, naopak jodid, je slabým oxidačným činidlom; slabší ako bróm, chlór a fluorid.
Jód s oxidačným číslom +1 sa dá kombinovať s inými halogénmi s oxidačným číslom -1, aby vznikol halogenidy jódu; Napríklad: jódový bromid. Kombinuje sa tiež s vodíkom, ktorý spôsobuje vodíkový jodid, ktorý sa po rozpustení vo vode nazýva kyselina iahydová.
Kyselina yodhorová je veľmi silná kyselina schopná formovať jodidy reakciou s kovmi alebo ich oxidmi, hydroxidmi a uhličitanymi. Jód má oxidačný stav +5 v kyseline yodnej (Hio3), ktorý je dehydratovaný na výrobu jódového pentoxidu (i2Ani5).
Elektronická štruktúra a konfigurácia
- Atóm jódu a ich odkazy
 Jódová diatomická molekula. Zdroj: Benjah-Bmm27 Via Wikipedia.
Jódová diatomická molekula. Zdroj: Benjah-Bmm27 Via Wikipedia. Jód v jeho bazálnom stave pozostáva z atómu, ktorý má sedem elektrónov vo Valencii, iba jeden z nich je schopný dokončiť svoj oktet a stať sa izolektronickým s vznešeným plynným xenónom. Týchto sedem elektrónov je usporiadaných na svojich orbitáloch 5S a 5p podľa ich elektronickej konfigurácie:
[KR] 4D10 5s2 5 P5
Preto atómy ukazujem silnú tendenciu kovalentne prepojiť, takže každý z nich má vo svojej vonkajšej vrstve osem elektrónov. Teda dva atómy sa priblížim a tvorím odkaz I-I, ktorý definuje diatomicku molekulu i2 (vynikajúci obraz); Molekulárna jednotka jódu v jeho troch fyzikálnych stavoch za normálnych podmienok.
Na obrázku je pozorovaná molekula i2 predstavuje model výplňového priestoru. Nielenže je to diatomická molekula, ale aj homonukleárna a apolar; Takže jeho intermolekulárne interakcie (i2 - Jo2) Sa riadia londýnskymi disperznými silami, ktoré sú priamo úmerné ich molekulárnej hmotnosti a veľkosti atómu.
Tento odkaz I-I je však slabší v porovnaní s ostatnými halogénmi (F-F, CL-Cl a BR-BR). To je spôsobené teoreticky ako zlé prekrývanie jeho SPO3.
- Kryštály
Molekulárna hmotnosť i2 Umožňuje, aby jeho disperzné sily boli dostatočne smerové a silné na vytvorenie ortombického skla pri okolitom tlaku. Vysoký obsah elektrónov spôsobuje, že svetlo podporuje symfíny na prechod energie, ktoré produkujú kryštály jódu.
Keď však jód sublimuje jeho výpary, vykazuje fialové sfarbenie. To už svedčí o špecifickejšom prechode na molekulárnych orbitáloch I2 (Tí, ktorí majú väčšiu energiu alebo antienlace).
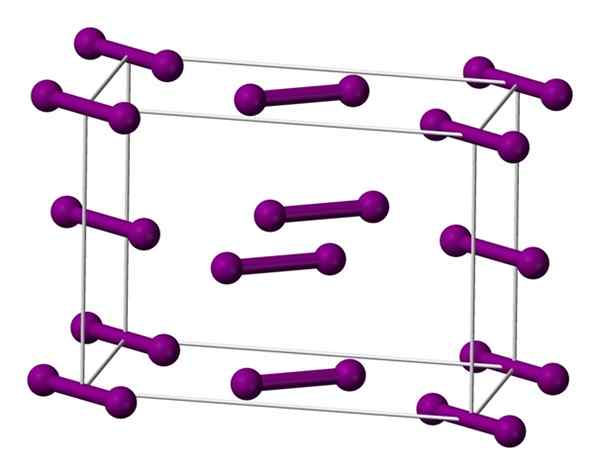 Unitárna orlombická bunka sústredená na základni pre jódový kryštál. Zdroj: Benjah-Bmm27 [verejná doména].
Unitárna orlombická bunka sústredená na základni pre jódový kryštál. Zdroj: Benjah-Bmm27 [verejná doména]. Molekuly, ktoré sú uvedené vyššie2, predstavuje model guľôčok a tyčí, usporiadaný vo vnútri ortorbickej bunky.
Je zrejmé, že existujú dve vrstvy: vrstvy nižšie s piatimi molekulami a médium so štyrmi. Všimnite si, že molekula jódu sa nachádza na spodnej časti bunky. Kryštál sa pravidelne konštruuje tieto vrstvy v troch rozmeroch.
Precestovanie smeru paralelne s odkazmi I-I sa zistilo, že orbitály jódu sa prekrývajú, aby sa generoval vodičský pás, ktorý sa vracia k tomuto prvku polovodič; Jeho schopnosť vykonávať elektrinu však zmizne, ak sa dodržiava smer kolmo na vrstvy.
Prepojenie
Zdá sa, že odkaz I-I bol oneskorený; A v skutočnosti je to tak, pretože dĺžka jeho prepojenia sa zvyšuje od 266 hod. (Plynný stav), 272 hod. (Solid State).
Môže to byť spôsobené skutočnosťou, že v plyne molekuly i2 Sú veľmi vzdialené, ich medzimolekulárne sily sú takmer zanedbateľné; Zatiaľ čo v pevnej látke sa tieto sily (I-I-I) stanú hmatateľnými a priťahujú atómy jódu dvoch susedných molekúl smerom k sebe a podľa intermolekulárnej vzdialenosti (alebo interatomickej, inak videného).
Môže vám slúžiť: Vzťah chémie s inými vedamiPotom, keď sa sublimálne jódové sklo, väzba I-I sa stiahne v plynnej fáze, pretože susedné molekuly už nevyvíjajú rovnakú silu príťažlivosti (disperzné) na svoje okolie. A tiež logicky vzdialenosť i2 - Jo2 zvýšenie.
- Fáza
Bolo uvedené vyššie, že odkaz I-I je v porovnaní s ostatnými halogénmi slabší. V plynnej fáze pri teplote 575 ° C, 1% molekúl i2 Rozpadajú sa na jednotlivé a atómy. Existuje toľko tepelnej energie, že iba dvaja a re -spájajú sa a tak ďalej.
Podobne môže dôjsť k prerušeniu tohto odkazu, ak sa použijú obrovské tlaky na kryštály jódu. Pri príliš komprimovaní (pod tlakom stovky tisíckrát vyšších ako atmosférické), molekuly i2 Sú usporiadané ako monoatomická fáza I a potom sa hovorí, že jód vykazuje kovové charakteristiky.
Existujú však aj iné kryštalické fázy, ako napríklad: Orthrome zameraný na telo.
Kde je to a získajte
Jód má váhový podiel vo vzťahu k zemskej kôre, 0,46 ppm, ktorá v nej obsadila miesto 61. Minerály Yoduro sú vzácne a ložiská jódu, ktoré sú komerčne využívané, sú Yodatos.
Minerály jódu sa nachádzajú v vyvraciach s horninami s koncentráciou 0,02 mg/kg pri 1,2 mg/kg a v magmatických horninách s koncentráciou 0,02 mg pri 1,9 mg/kg. Nachádza sa tiež v Kimmeridge Lutita s koncentráciou 17 mg/kg hmotnosti.
Okrem toho sa minerály jódu nachádzajú vo fosfátových horninách s koncentráciou v rozsahu medzi 0,8 a 130 mg/kg. Morská voda má koncentráciu jódu, ktorá sa pohybuje od 0,1 do 18 µg/l. Riasy, špongie a morské ustrice boli predtým hlavnými zdrojmi jódu.
Hlavnými zdrojmi sú však kalich, ložiská dusičnanu sodného v púšti Atacama (Čile) a Salmuelas, najmä zdroje japonského plynového poľa v Minami Kanto, východne od Tokia, a plynové poľa Anadarko v Oklahome (USA. ).
Kalich
Jód sa extrahuje z jódinus caliche a je ošetrený bisulfitom sodným, aby sa znížil na jodid. Potom roztok reaguje s novo extrahovaným Yodato, aby sa uľahčila jeho filtrácia. Kalich bol hlavným zdrojom jódu v devätnástom a začiatkom dvadsiateho storočia.
Soľanka
Po čistení sa soľanka ošetrí kyselinou sírovou, ktorá produkuje jodid.
Tento roztok jodidu následne reaguje s chlórom, aby sa vytvoril zriedený roztok jódu, ktorý sa odparuje pomocou vzduchového prúdu, ktorý sa odchyľuje k absorpčnej veži oxidu siričitého, čo produkuje nasledujúcu reakciu:
Jo2 + 2 h2Alebo +SO2 => 2 hi +h2SW4
Následne plynný jodíkový plyn reaguje s chlórom a uvoľňuje jód v plynnom stave:
2 HI +CL2 => I2 + 2 HCl
A nakoniec, jódové filtre, čistenie a balenie na použitie.
Biologický dokument
- Odporúčaná strava
Jód je nevyhnutným prvkom, pretože zasahuje do mnohých funkcií v živých bytostiach, ktoré sú obzvlášť známe u ľudí. Jediný spôsob vstupu jódu do človeka sú potraviny, ktoré požíva.
Odporúčaná strava jódu sa líši v závislosti od veku. Takže 6 -mesiac -old chlapec vyžaduje príjem 110 µg/deň; Ale od 14 rokov je odporúčaná strava 150 µg/deň. Okrem toho sa uvádza, že príjem jódu by nemal prekročiť 1.100 µg/deň.
- Hormóny štítnej žľazy
Hormón stimulujúci štítnu žľazu (TSH) je vylučovaný hypofýzou a stimuluje jód s folikulom štítnej žľazy. Jód sa prenáša vo vnútri folikulov štítnej žľazy, známy ako koloidy, kde sa viaže na aminokyselinový tyrozín a vytvára monoyodotyrozín a diiodotyrozín.
V folikulárnom koloide, monoyodirosín3). Na druhej strane je možné spojiť dve molekuly diiodotyrozínu, čím sa tvoria tetrarydotyrón (t4). T3 a t4 Sú to tak -zavolané hormóny štítnej žľazy.
Hormóny t3 a t4 Sú vylučované do plazmy, kde sa viažu na plazmatické proteíny; Medzi nimi dopravný proteín hormónov štítnej žľazy (TBG). Väčšina hormónov štítnej žľazy sa transportuje v plazme ako T4.
Aktívna forma hormónov štítnej žľazy je však T3, Takže t4 V „bielych orgánoch“ hormónov štítnej žľazy, zážitky a transformácie na T3 Cvičiť svoju hormonálnu akciu.
Účinky
Účinky pôsobenia hormónov štítnej žľazy sú viacnásobné, čo je možné zdôrazniť nasledujúce: zvýšenie metabolizmu a syntézy proteínov; podpora rastu tela a vývoja mozgu; Zvýšený krvný tlak a srdcový rytmus atď.
- Nedostatok
Nedostatok jódu, a preto hormóny štítnej žľazy, známe ako hypotyreóza, má početné následky, ktoré sú ovplyvnené vekom človeka.
Ak dôjde k nedostatku jódu počas plodného stavu osoby, najdôležitejším dôsledkom je kreatinizmus. Tento stav sa vyznačuje príznakmi, ako je zhoršenie mentálnej funkcie, oneskorenie fyzického vývoja, strudizmus a neskoré sexuálne dozrievanie.
Môže vám slúžiť: meď: História, vlastnosti, štruktúra, použitie, biologický papierNedostatok jódu môže vyvolať strunu, bez ohľadu na vek, v ktorom dochádza k nedostatku. Odrastanie je nadmerný vývoj štítnej žľazy, spôsobený nadmernou stimuláciou žľazy hormónom TSH, uvoľňovaným z hypofýzy v dôsledku nedostatku jódu.
Nadmerná veľkosť štítnej žľazy (goiter) môže komprimovať priedušnicu, čím obmedzuje priechod vzduchu cez ňu. Okrem toho môže spôsobiť poškodenie hrtanových nervov, ktoré môžu mať v dôsledku toho rum.
Riziká
Otrava v dôsledku nadmerného príjmu jódu môže spôsobiť popáleniny v ústach, krku a horúčke. Tiež bolesť brucha, nevoľnosť, zvracanie, hnačka, slabý pulz a kóma.
Prebytok jódu spôsobuje niektoré symptómy pozorované pri nedostatku: existuje inhibícia syntézy hormónov štítnej žľazy, takže uvoľňovanie TSH sa zvyšuje, čo vedie k hypertrofii štítnej žľazy; To znamená, goiter.
Existujú štúdie, ktoré naznačujú, že nadmerný príjem jódu môže spôsobiť rakovinu štítnej žľazy papilár. Okrem toho môže nadmerný príjem jódu interagovať s liekmi obmedzením jeho pôsobenia.
Nadmerný príjem jódu s antithyreoidnými liekmi, ako je metimazol, používaný na liečbu hypertyreózy, môže mať aditívny účinok a spôsobiť hypotyreózu.
Inhibítory enzýmu prevodu angiotenzínu (ECA), ako je Benazepril, sa používa pri liečbe hypertenziou. Prijímanie nadmerného množstva jodidu draselného zvyšuje riziko hyperkalémie a hypertenzie.
Žiadosti
Lekári
Jód pôsobí ako dezinfekčný prostriedok kože alebo rany. Má takmer snímku antimikrobiálny účinok, prenikne do mikroorganizmov a interaguje s aminokyselinami síry, nukleotidmi a mastnými kyselinami, ktoré spôsobujú bunkovú smrť.
Venuje svoje antivírusové akcie zásadne na krytých vírusoch, čo predpokladá, že útočí na povrch pokrytých vírusov.
Jodid draselný v koncentrovanom roztoku sa používa pri liečbe tyreotoxikózy. Používa sa tiež na kontrolu účinkov žiarenia 131Ja pri blokovaní spojenia rádioaktívneho izotopu do štítnej žľazy.
Jód sa používa pri liečbe dendritickej keratitídy. Z tohto dôvodu je vystavená rohovky na výpary nasýtenej vody jódom, epitel rohovky sa dočasne stráca; Ale do dvoch alebo troch dní je to úplné uzdravenie.
Jód má tiež prospešné účinky na liečbu ľudskej sínusovej fibrózy. Podobne bolo zdôraznené, že 131Mohol by som byť voliteľnou liečbou rakoviny štítnej žľazy.
Reakcie a katalytické pôsobenie
Jód sa používa na detekciu prítomnosti škrobu, čo dáva modré sfarbenie. Reakcia jódu s škrobom sa tiež používa na detekciu prítomnosti falošných lístkov vytlačených na papieri obsahujúcom škrob.
Pri detekcii amoniaku sa používa draslík (ii) tetrayodomerkurát, známy tiež ako Nessler Reagent. Podobne sa pri teste jódform používa roztok alkalického jódu, ktorý ukazuje prítomnosť metylcetonous.
Anorganický jodid. V štádiu procesu sa musia vytvoriť tetrayoduros týchto kovov.
Jód slúži ako stabilizátor pre Colfonia, olej a ďalšie výrobky z dreva.
Jód sa používa ako katalyzátor v reakciách organickej syntézy metylácie, izomerizácie a dehydrogenácie. Medzitým sa kyselina iarovodíková používa ako katalyzátor na výrobu kyseliny octovej v procesoch Monsanto a Cativa.
Jód pôsobí ako katalyzátor v kondenzácii a alpozícii aromatických amínov, ako aj v procesoch sulfatizácie a sulfanácie a na výrobu syntetických gumov.
Fotografia a optika
Silver Yoduro je nevyhnutnou súčasťou tradičného fotografického filmu. Jód sa používa pri výrobe elektronických nástrojov, ako sú jedinečné sklenené hranoly, polarizačné optické nástroje a sklo schopné prenášať infračervené lúče.
Iné použitia
Jód sa používa pri vypracovaní farbív pesticídov, anilínu a ftaleína. Okrem toho sa používa v syntéze farbív a je látkou na hasenie dymu. A nakoniec, strieborný jodid slúži ako jadro kondenzácie vodnej pary v oblakoch, aby spôsobil dážď.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Stuart Ira Fox. (2003). Ľudská fyziológia. Prvá edícia. Upraviť. McGraw-Hill Inter-American
- Wikipedia. (2019). Jód. Zdroj: In.Wikipedia.orgán
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi a Onoda Mitsuko. (2003). Modulovaná struptúra tuhého jódu počas molekulárnej disociácie STI und. Prírodný objem 423, strany971-974. doi.org/10.1038/Nature01724
- Chen l. a kol. (1994). Štrukturálne fázové prechody jódu pri vysokom tlaku. Inštitút fyziky, Sinica Academy, Peking. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider a Karl Christe. (26. augusta 2019). Jód. Encyclopædia Britannica. Získané z: Britannica.com
- DR. Doug Stewart. (2019). Fakty jódového prvku. Chemickolák. Získané z: Chemicool.com
- Národné centrum pre biotechnologické informácie. (2019). Jód. Databáza pubchem. CID = 807. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Rohner, f., Zimmermann, m., Jooste, P., Pandav, C., Caldwell, K., Raghavan, r., & Raiten, D. J. (2014). Biomarkery výživy pre vývoj-preskúmanie jód. The Journal of Nutrition, 144 (8), 1322S-1342S. Doi: 10.3945/jn.113.181974
- ADVAMEG. (2019). Jód. Vysvetlila chémia. Získané z: ChemistryExplaed.com
- Traci Pedersen. (19. apríla 2017). Fakty o jóde. Zotavené z: Livescience.com
- Megan Ware, RDN, LD. (30. mája 2017). Všetko, čo potrebujete vedieť o jódovi. Získané z: MedicalNewstody.com
- Národný inštitút zdravia. (9. júla 2019). Jód. Zdroj: SDG.Odplaziť.NIH.Vláda
- « Kripton História, vlastnosti, štruktúra, získanie, riziká, použitie
- Mary Celeste predchodca, udalosti, teórie »

