Štruktúra oxidu horečnatý, vlastnosti, nomenklatúra, používa

- 883
- 223
- Václav Višňovský
On oxid horečnatého Je to kryštalická biela anorganická tuhá látka známa aj ako magnézia. Jeho chemický vzorec je MGO a je tvorený oxidáciou kovu horčíka kyslíkom.
Často sa nachádza ako prírodný minerál nazývaný periclas. Perikláza však nie je dôležitým zdrojom MGO. V prírode sa bežne vyskytuje ako skupiny kryštálov v mramoru.
 Oxid horčíka. Adam Rędikowski [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Zdroj: Wikipedia Communstation sa nachádza aj v mineráli Magnesita (ktorý je hlavne uhličitan horečnatý s určitými železnými karbonátmi); vo vápencovi a dolomite (minerál tvorený horčík a uhličitany vápenatého); v sopečných vyhadzovaniach a v hadých skalách.
Oxid horčíka. Adam Rędikowski [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Zdroj: Wikipedia Communstation sa nachádza aj v mineráli Magnesita (ktorý je hlavne uhličitan horečnatý s určitými železnými karbonátmi); vo vápencovi a dolomite (minerál tvorený horčík a uhličitany vápenatého); v sopečných vyhadzovaniach a v hadých skalách.
Netvorte horniny ani kryštálové usadeniny, pretože v kontakte s vodnou parou atmosféry sa stáva hydroxidom horčíka (mg (OH)2).
Na priemyselnej úrovni je možné získať niekoľkými spôsobmi: kalcinácia horčíka uhličitanu (magnezit), kalcinácia hydroxidu horčíka, z dolomitického vápenca, morskou vodou a pyrolýzou chloridu horečnatého, okrem iných metód.
Produkcia Magnesia začala z Magnesita pred viac ako 100 rokmi v Rakúsku. Odvtedy má Magnesia niekoľko technických aplikácií kvôli svojmu najvyššiemu bodu zlúčenia, chemického odporu, vysokej tepelnej vodivosti, nízkej elektrickej vodivosti a biologickej aktivity.
[TOC]
Štruktúra
Kryštalická štruktúra MGO je kubická, zameraná na tváre, podobne ako v prípade kryštálovej siete chloridu sodného (NaCl).
Magnesia tvorí kubické kryštály hexaoctahébédicas, ktoré môžu byť bezfarebné, zelené alebo hnedé.
Periclass Mineral je malý oktaedron, ktorý je menej často kockovým oktaedro alebo Dodecahedron.
Vlastnosti
Ostatné mená
- Magnézia.
- Periclas.
- Oxomagnézia.
Fyzický stav
Je pevná, kryštalická a biela. Aj keď prítomnosť nečistôt železa prepožičiava zelenkavé alebo hnedé sfarbenie podľa stupňa oxidácie železa.
Mohs tvrdosť
5.5-6.
Molekulová hmotnosť
40 304 g/mol.
Bod topenia
2827 ° C.
Hustota
3 581 g/cm3
Rozpustnosť
Prakticky nerozpustné vo vode:
0,00062 g na 100 ml pri 20 ° C.
0,0086 g na 100 ml pri 30 ° C.
Nerozpustný v etanole.
pH
V nasýtenom vodnom roztoku: 10,3.
Môže vám slúžiť: oxid vápenatý (CAO)Optické vlastnosti
Priehľadný. Farba: bezfarebná, šedo biela, hnedasto žltá, bezfarebná v prenášanom svetle.
Index lomu
1 7355 až 589 nm.
1 7283 až 750 nm.
Ďalšie vlastnosti
- Má vysokú tepelnú vodivosť a vysoký elektrický odpor.
- Je hygroskopický, ktorý je ľahko absorbovaný vodou z atmosféry. Vo vodnom médiu je kombinovaný s vodou, aby sa vytvoril hydroxid horčíka.
- Je stabilná v oxidačnej atmosfére na 2300 ° C a až 1700 ° C v redukčnej atmosfére.
- Je kompatibilný s väčšinou chemických zlúčenín, okrem iného s výnimkou silných kyselín a oxidantov.
- Po zapaľovaní pri vysokých teplotách je oxid horečnatý relatívne inertný.
- Nie je toxický. Preventívne opatrenia by sa však mali prijať pri manipulácii vo forme prachu, keď má malú veľkosť častíc.
- Ich kryštály majú vysokú reflexnú silu vo viditeľnom spektre aj v blízkosti ultrafialových látok.
Menovanie
Existuje niekoľko stupňov MGO, ktoré sa dodávajú komerčne:
Žieravec
Je to vysoko reaktívna forma oxidu horečnatého produkovaného kalcináciou alebo spaľovaním surového magnezitu (MGCO3) alebo hydroxid horečnatý (mg (OH)2) Pri relatívne nízkych teplotách, ale nad teplotou rozkladu týchto materiálov, medzi 700 a 1 000 ° C.
Nazýva sa tiež kalcinovaná žieravá magnézia, kalcinovaný oxid horečnatý, reaktívny oxid horečnatý, magnézia mierne spaľovaná (anglický preklad Spaľovaný), Okrem iných mien.
Herdic Magnesia sa môže spáliť pri vyššej teplote, aby sa spintring Magnézia.
Magnézia silne spálená
Vyskytuje sa, keď sa magnezit vypočíta pri teplotách od 1 000 do 1500 ° C. Jeho reaktivita sa znížila v porovnaní s žieravým magnéziou.
Magnézia rEfraktario
Keď sa magnezit vypočíta pri teplotách medzi 1500 a 2000 ° C, „Smrťová spálená“ (preklad angličtiny Uľavený), tiež nazývaná refraktérna magnézia alebo roztavená magnézia.
Folk Magnesia sa získa aj fúziou žieravej magnézie v elektrickom oblúku. V dôsledku týchto ošetrení bola ich reaktivita takmer úplne vylúčená.
Tento typ magnézie je všeobecne modelovaný tlakom a teplotou, bez dosiahnutia teploty fúzie. Toto prichádza k tomu, aby sa vytvorila veľká tvrdosť a volá sintrujúcu magnéziu. Je v podstate stabilný proti vlhkosti a atmosférickému oxidu uhličitého.
Môže vám slúžiť: Adiabatický proces: typy, príklady, vyriešené cvičeniaŽiadosti
MGO sa používa pri výrobe kovového horčíka.
Použitie žieravej magnézie
Vďaka svojej vysokej reaktivite sú jeho priemyselné aplikácie veľmi rozmanité.
Používa sa ako surovina na výrobu cementu.Používa sa napríklad v stavebníctve, napríklad ako Binder. V tomto prípade sa zmieša s koncentrovanými roztokmi solí horčíka a malým množstvom fosforečnanu sodného.
Tak sa získa extrémne tvrdý materiál. Aj keď to nie je skutočný cement, pretože nie je stabilný vo vode, môže sa použiť ako ochranný stožiar alebo povlaky.
Herdic Magnesia sa tiež používa vo svetelných stavebných doskách na tepelnú a akustickú izoláciu. Vyrábajú sa pridaním síranu horečnatého ako spojivo a minerálna vlna. Sú to vysoko neplatiteľné listy.
 Stavebné listy. Eccentrik13 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Zdroj: Wikipedia Commontsents Ostatné použitia žieravých magnézií sú odstraňovanie ťažkých kovov a kremičitan z odpadovej vody. Môžete tiež odstrániť amoniak alebo fosfáty.
Stavebné listy. Eccentrik13 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Zdroj: Wikipedia Commontsents Ostatné použitia žieravých magnézií sú odstraňovanie ťažkých kovov a kremičitan z odpadovej vody. Môžete tiež odstrániť amoniak alebo fosfáty.
Je to slabá základňa, takže slúži ako kyslý neutralizátor a používa sa pri umývaní plynu komína, ako prísadka pre mazivá a palivá.
Slúži ako vyplnenie plastového a gumového priemyslu, pretože umožňuje úpravu viskozity a tuhosti týchto materiálov.
Používa sa v priemysle papiera a celulózy, pretože sa podieľa na trávení bisulfitu. Tiež ako absorbent vlhkosti v knižniciach alebo na prípravu kozmetiky. Okrem toho je vo farmaceutickom priemysle vysoko hodnotený ako antacid, úľava za trávenie a mäkké preháňadlo.
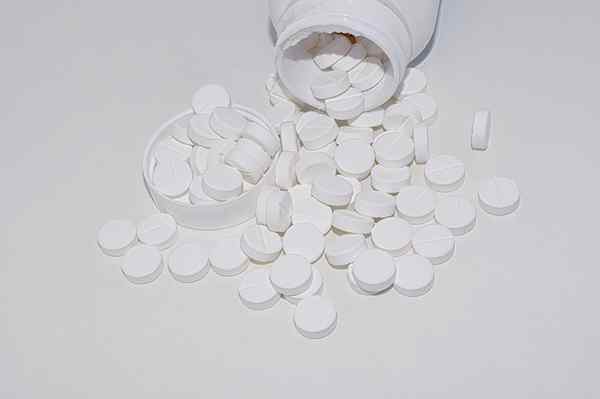 Tablety MGO. Zdroj: Pixabay
Tablety MGO. Zdroj: Pixabay Použitie silne spálenej magnézie
Vďaka svojmu úzkemu intervalu reaktivity sa používa v aplikáciách, kde je potrebná pomalá degradácia. Napríklad v doplnkoch pre potraviny pre zvieratá. Je to preto, že za určitých podmienok môžu hospodárske zvieratá trpieť nedostatkom horčíka, ak je kŕmené iba krmivom.
Na druhej strane je známe, že horčík (mg) je základným prvkom chlorofylu. Preto sa považuje za nevyhnutnú živinu rastlín a používa sa ako hnojivo. Spôsob, ako pridať horčík do rastlín, je ako magnézia.
Môže vám slúžiť: oxid železaTento typ MGO sa môže použiť v rôznych aplikáciách: keramika, čistenie odpadových vôd (ako je katión Adsorbent pri odstraňovaní kovu), opálenie kože a suroviny pre roztavenú magnéziu.
Použitie sinserizovanej magnézie a zakladajúcej magnézie
MGO má najvyšší bod topenia medzi miernymi oxidmi nákladov, a preto je surovinou pre žiaruvzdorné tehly a inú žiaruvzdornú keramiku. Je to jediný materiál po oxidu zroch (Zro2), ktoré môže vydržať predĺžené otepľovanie nad 2000 ° C.
Tento refraktérny stupeň MGO sa používa v oceľovom priemysle na výrobu ochranných zábalov a vymeniteľných povlakov zariadení, ktoré manipulujú s roztavenou oceľou, napríklad veľmi vysoký výkon.
 Vysoko výkonné rúry v oceliarskom priemysle. Grandmont Jean-Pol [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Zdroj: Commonsdebido Wikipedia do svojej takmer nulovej miery reaktivity, refraktérne stavebné materiály založené na sintringových magnézii sú tiež odolné voči troskám a základným alebo neutrálnym plynom.
Vysoko výkonné rúry v oceliarskom priemysle. Grandmont Jean-Pol [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Zdroj: Commonsdebido Wikipedia do svojej takmer nulovej miery reaktivity, refraktérne stavebné materiály založené na sintringových magnézii sú tiež odolné voči troskám a základným alebo neutrálnym plynom.
Sincorizované magnézske bloky majú vysokú kapacitu tepla a vysokú tepelnú vodivosť (veľmi dobre vedú teplo).
Teplo generované vykurovacím prvkom sa prenáša do bloku magnézie a zvyšuje jeho teplotu. Z tohto dôvodu sa používajú v zariadeniach s horúcimi úložnými zariadeniami.
Používa sa ako izolačný materiál v priemysle elektrického vykurovania súvisiace s domácimi artefaktmi. Napríklad v prípade rúrkových prvkov vykurovania kuchynských pecí, práčky, kávovarov, elektrických tanierov alebo radiátorov.
Iné použitia MGO
Vysoký reflexný výkon kryštálov MGO vo viditeľnom a UV spektre viedol k jeho použitiu ako reflektor v optických prístrojoch a ako jedinečné kryštály v optických oknách a šošovkách. Používa sa tiež ako biely štandard.
Odkazy
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Zväzok 15. Štvrté vydanie. John Wiley & Sons.
- Ullmannova encyklopédia priemyselnej chémie. Zväzok A15. Piaty vydanie.
- Tanec, J.C.; Emeléus, h.J.; a Sir Ronald Nyholm. (1973). Komplexná anorganická chémia. Redakcia. Pergamón.
- Siež. Lekárska knižnica. (2019). Oxid horečnatého. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Americké prvky (2019). Žieravá kalcinovaná magnézia. Zotavené z americalmentov.com.
- Ropp, r.C. (2013). Skupina 16 (O, S, SE, TE) Zlúčeniny alkalických zemín. Oxid horečnatého. V encyklopédii alkalických Zemech Zeme. Zotavené z vedeckých pracovníkov.com.
- « Jednoduché ploché charakteristiky epitelu, funkcie a typy
- Xiuhtecuhtli atribúty, mytológia a kulty »

