Oxid lítium
- 748
- 120
- Tomáš Klapka
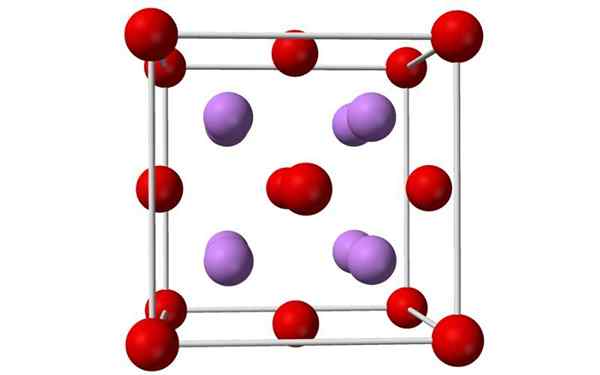
 Gule a stĺpce model jednotkovej bunky oxidu lítium. Zdroj: Benjah-Bmm27, Wikimedia Commons
Gule a stĺpce model jednotkovej bunky oxidu lítium. Zdroj: Benjah-Bmm27, Wikimedia Commons Čo je oxid lítium?
On Oxid lítium Je to anorganická chemická zlúčenina vzorca li li2Alebo sa tvorí spolu s malým množstvom peroxidu lítia, keď sa kov lítia spálený vo vzduchu a kombinuje sa s kyslíkom.
Až do 90. rokov dominovala trh s kovmi a lítiami z americkej výroby z ložísk minerálov, ale na začiatku 21. storočia bola väčšina výroby odvodená z iných zdrojov: Austrália, Čile a Portugalsko boli najdôležitejšími dodávateľmi na svete. Bolívia má na svete polovicu lítia, ale nie je to skvelý producent.
Najdôležitejšou obchodnou formou je uhličitan lítium, li2Co3, Vyrábané z minerálov alebo salmulov niekoľkými rôznymi procesmi.
Keď lítium horí vo vzduchu, hlavným produktom je oxid oxidu bieleho lítium, Li2Ani. Okrem toho sa vyskytuje nejaký peroxid lítium, li2Ani2, Tiež biela.
Dá sa to tiež vykonať tepelným rozkladom hydroxidu lítium, lioh alebo peroxidu lítium, li2Ani2.
4li (s) + o2g) → 2li2Ty)
2LOH (s) + teplo → Li2Alebo (s) + h₂o (g)
2li2Ani2(s) + teplo → 2li2Alebo (s) + alebo2g)
Fyzikálne a chemické vlastnosti
- Oxid lítium je biela pevná látka známa ako Lithia, ktorá nemá arómu a má slanú chuť.
- Oxid lítium sú kryštály s antifloritovou geometriou, podobne ako chlorid sodný (kubický sústredený na tváre).
- Jeho molekulová hmotnosť je 29,88 g/mol, jej hustota je 2 013 g/ml a body fúzie a varu sú 1438 ° C a 2066 ° C, respektíve 2066 ° C.
Môže vám slúžiť: epid- Zlúčenina je veľmi rozpustná vo vode, alkoholu, éteru, pyridíne a nitrobenzéne.
- Oxid lítium ľahko reaguje s vodnou parou za vzniku hydroxidu a oxid uhličitý za vzniku uhličitanu; Preto sa musí skladovať a spravovať v čistej a suchej atmosfére.
- Oxidové zlúčeniny nevykonávajú elektrinu. Určité štruktúrované oxidy Perovskita sú však elektronické vodivé, ktoré nájdu aplikáciu v katóde katódy s palivovými článkami tuhého oxidu a systémov výroby kyslíka.
- Sú to zlúčeniny, ktoré obsahujú aspoň jeden kyslíkový anión a kovový katión.
Riziká
Oxid lítia je stabilná zlúčenina nekompatibilná so silnými kyselinami, vodou a oxidom uhličitým. Pokiaľ vieme, chemické, fyzikálne a toxikologické vlastnosti oxidu lítia neboli skúmané a dôkladne hlásené.
Toxicita lítiových zlúčenín je funkciou ich rozpustnosti vo vode. Lítium ión má toxicitu v centrálnom nervovom systéme. Zlúčenina je vysoko korozívna, dráždi, ak prichádza do kontaktu s očami a pokožkou, keď je vdýchnutá alebo požívaná.
V prípade kontaktu s očami musíte overiť, či sa používajú kontaktné šošovky, a okamžite ich odstráňte. Musia byť opláchnuté tečúcou vodou najmenej 15 minút, pričom viečka sú otvorené. Môže sa použiť studená voda, a nie očná masť.
Ak chemikália príde do styku s oblečením, zachovajte ju čo najrýchlejšie a chráňte svoje vlastné ruky a telo. Položte obeť pod bezpečnostnú sprchu.
Ak sa chemická látka hromadí v exponovanej pokožke obete, ako sú ruky, pokožka kontaminovaná tečúcou vodou a neabrazzívne mydlo je jemne umyté a opatrne. Môže sa použiť studená voda. Ak podráždenie pretrváva, vyhľadajte lekársku pomoc. Pred opätovným použitím umyte kontaminované oblečenie.
Môže vám slúžiť: Rankine Scale: Čo je, konverzie, príkladyV prípade vdýchnutia by sa obeť mala nechať stáť v dobre vetranej oblasti. Ak je inhalácia vážna, obeť sa musí čo najskôr evakuovať do bezpečnej oblasti.
Uvoľnite tesné oblečenie, ako sú krky, pásy alebo kravata. Ak je obeť ťažké dýchať, musí sa podávať kyslík. Ak obeť nedýcha, urobí sa resuscitácia úst v ústach.
Vždy berúc do úvahy, že to môže byť nebezpečné pre osobu, ktorá poskytuje pomoc pri poskytovaní resuscitácie úst, keď je vdýchnutý materiál toxický, infekčný alebo korozívny. Vo všetkých prípadoch by sa mala hľadať okamžitá lekárska starostlivosť.
Žiadosti
- Oxid lítia sa používa ako zakladateľ v keramických smaltkách a vytvára modrú s meďou a ružami s kobaltom. Reaguje s vodou a parou, ktorá vytvára hydroxid lítium a mal by sa od nich izolovať.
- Oxid lítia (li2O), so svojím vysokým potenciálom Tritio je atraktívnym kandidátom na materiál na kultiváciu tuhého kultivácie rastliny DT fúznej energie kvôli svojej vysokej hustote atómov lítia (v porovnaní s inými lítiami alebo kovovou lítiovou keramikou) a relatívne vysokou tepelnou vodivosťou) a relatívne vysokej tepelnej vodivosti.
Li2O Budú vystavené vysokým teplotám pri ožiarení neutrónom počas prevádzky fúznych prikrývok. Za týchto okolností sa v Li vytvorí veľké množstvo ožarovacích defektov2Alebo, napríklad opuch hélium, relatívne vysoká tepelná expanzia, rast zŕn, tvorba Lyh (T) a zrážky pri nízkych teplotách a transport hmotnosti LIOH (T) pri vysokých teplotách.
Okrem toho Li2Alebo podlieha napätiu, ktoré vyplýva z rozdielov tepelnej expanzie medzi Li2O a konštrukčné materiály. Tieto vlastnosti Li2Alebo viesť k náročným inžinierskym problémom vo výrobe aj v dizajne Manta.
Môže vám slúžiť: Stroncium Hydrid (SRH2)- Možné nové použitie je ako náhrada za kobalt a oxid lítium, ako je katóda v lítiových batériách používaných na zvýšenie elektronických zariadení mobilných telefónov do notebookov, ako aj automobilov s batériami.
Odkazy
- Americké prvky. Oxid lítium. Zotavené z amerických americalmentov.com.
- Oxid lítium. Zotavené z espimetals espimetals.com.
- Oxid lítia (LI2O). FERP sa získal.Ucsd.Edu ferp.Ucsd.Edu.

