Štruktúra oxidu fosforu (V), vlastnosti, získanie, použitie, riziká

- 4439
- 408
- Alfréd Blaho
On Oxid fosfor (V) Je to anorganická tuhá látka tvorená fosforom (P) a kyslíkom (O). Jeho empirický vzorec je P2Ani5, zatiaľ čo jeho správny molekulárny vzorec je p4Ani10. Je to veľmi hygroskopická biela tuhá látka, to znamená, že môže veľmi ľahko absorbovať vzduch zo vzduchu a okamžite s tým reaguje. Reakcia môže byť nebezpečná, pretože spôsobuje rýchle zvýšenie teploty.
Jeho vysoká tendencia absorbovať vodu spôsobila, že sa používa ako sušiace činidlo v chemických laboratóriách, ako aj dehydratácia niektorých zlúčenín, tj eliminuje vodu z jej molekúl.
 Prášok oxidu fosforu (V), P4Ani10. Lhchem [CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Prášok oxidu fosforu (V), P4Ani10. Lhchem [CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Oxid fosfor (V) sa tiež používa na urýchlenie väzbových reakcií molekúl rôznych uhľovodíkov, čo je reakcia nazývaná kondenzácia. Okrem toho umožňuje premeniť určité organické kyseliny na estery.
Používa sa napríklad na vylepšenie benzínu, na prípravu kyseliny fosforečnej h3Po4, Na získanie zlúčenín, ktoré slúžia na oneskorenie požiaru, na výrobu skla pre vákuové aplikácie, okrem iných použití.
Oxid fosfor (V) by sa mal udržiavať v dobre preložených nádobách, aby sa zabránilo kontaktu s vlhkosťou zo vzduchu. Je korozívny a môže poškodiť oči, pokožku a sliznicu.
[TOC]
Štruktúra
Oxid fosfor (V) sa tvorí fosforom (p) a kyslíkom (O), kde fosfor má valenciu +5 a kyslík -2. Molekula oxidu fosforu (V) má štyri fosfor a desať atómov kyslíka, a preto je jeho správny molekulárny vzorec P P je p4Ani10.
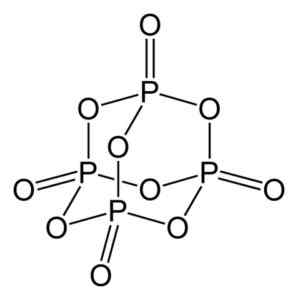 Štruktúra molekuly oxidu fosforu (V), P4Ani10. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons.
Štruktúra molekuly oxidu fosforu (V), P4Ani10. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons. Existuje v troch kryštalických formách, ako je amorfný prach a v sklovi (napríklad sklo). V hexagonálnej kryštalickej forme sa každý z atómov fosforu nachádza vo vrcholoch tetraedronu.
Menovanie
- Oxid fosfor (V)
- Fosfor pentoxid
- Difosfázový pentoxid
Môže vám slúžiť: rozpúšťadlo: Koncept, typy a príklady- Fosforečný pentoxid
- Anhydrid fosforečky
- Rozpad tetrafosforu
Vlastnosti
Fyzický stav
Kryštalická biela pevná látka. Najbežnejšou formou je forma šesťuholníkových kryštálov.
Molekulová hmotnosť
283,89 g/mol
Bod topenia
562 ° C
Sublimačná teplota
360 ° C na 1 tlakovú atmosféru. To znamená, že pri tejto teplote prechádza z plynovej tuhej látky bez toho, aby prešiel tekutým stavom.
Hustota
2,30 g/cm3
Rozpustnosť
Veľmi rozpustné vo vode. Rozpustná kyselina sírová. Nerozpustný v acetóne a amoniaku.
Chemické vlastnosti
Oxid fosfor (V) absorbuje a reaguje so vzduchom zo vzduchu s extrémne rýchlo tvorujúcim kyselinu fosforečnú H3Po4. Táto reakcia je exotermická, čo znamená, že teplo sa vytvára v rovnakom.
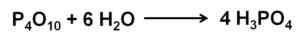 Fosfor (V) oxidová reakcia s vodou za vzniku kyseliny fosforečnej h3Po4. Autor: Marilú Stea.
Fosfor (V) oxidová reakcia s vodou za vzniku kyseliny fosforečnej h3Po4. Autor: Marilú Stea. Reakcia P4Ani10 s vodou vedie k tvorbe zmesi kyselín fosforečnej, ktorej zloženie závisí od množstva vody a podmienok.
Reakcia s alkoholmi vedie k tvorbe esterov kyseliny fosforečnej alebo kyseliny polymérnej v závislosti od experimentálnych podmienok.
P4Ani10 + 6 ROH → 2 (RO)2Po.Oh + 2 ro.Po (oh)2
So základnými oxidmi tvoria pevné fosfáty.
Je to korozívne. Môže nebezpečne reagovať s kyselinou mravčou a anorganickými bázami, ako je hydroxid sodný (NaOH), oxid vápenatý (CAO) alebo uhličitany sodný NA2Co3.
Ak sa naleje roztok kyseliny percrórovej HCLO4 a chlór CHCl3 V oxidu fosforu (V) p4Ani10 Dochádza k násilnej explózii.
Ďalšie vlastnosti
Nie je to horľavé. Nepredporuje spaľovanie. Jeho reakcia vody je však taká násilná a exotermická, že môže existovať riziko požiaru.
Získanie
Môže sa pripraviť priamou oxidáciou fosforu v prúde suchého vzduchu. Fosfor, keď sa oxiduje nadbytok kyslíka, ktorý tvorí oxid fosfor (V).
P4 + 5 o2 → P4Ani10
Prítomnosť v prírode
Oxid fosfor (V) sa nachádza v mineráloch, ako je ilmenit, rutilo a zircón.
Môže vám slúžiť: Aké sú anorganické chemické funkcie?Ilmenit je minerál, ktorý obsahuje železo a titán a niekedy má oxid fosfor (V) v koncentráciách, ktoré sa pohybujú medzi 0,04 a 0,33% hmotnosti. Rutilo je minerál oxidu oxidu titánu a môže obsahovať približne 0,02% hmotnosti P2Ani5.
Zirkón piesky (minerál prvku zirkónia) majú oxid fosfor (V) pri hmotnosti 0,05-0,39%.
Žiadosti
Ako dehydratačný a secant agent
Vzhľadom na svoju veľkú aviditu pre vodu je jedným z najznámejších a veľmi účinných dehydratačných činidiel pri teplotách menších ako 100 ° C.
Môže extrahovať vodu z látok, ktoré sa považujú za dehydratačné činidlá. Napríklad môžete odstrániť vodu z kyseliny sírovej H2SW4 robiť to tak3 a kyselina dusičná HNO3 Premenenie na n2Ani5.
 Dehydratácia kyseliny sírovej v dôsledku oxidu fosforu (V). Autor: Marilú Stea.
Dehydratácia kyseliny sírovej v dôsledku oxidu fosforu (V). Autor: Marilú Stea. V podstate môže vysušiť všetky tie tekutiny a plyny, s ktorými nereaguje, takže umožňuje odstraňovať stopy vlhkosti z vákuových systémov.
V reakciách organickej chémie
Oxid fosfor (V) slúži na zatvorenie krúžkov organických zlúčenín a iných kondenzačných reakcií.
Umožňuje sterifikovať organické kyseliny s možnosťou rozlíšiť medzi primárnymi alifatickými karboxylovými kyselinami (sýtený reťazec bez krúžkov so skupinou -COOH na jednom konci) a aromatickými kyselinami (skupinová -cOH spojená s benzénovým kruhom), pretože posledne menovaná.
Slúži tiež na odstránenie molekuly H2Alebo Amidas r (c = o) nh2 A robí z nich nitrily r-cn. Okrem toho katalyzuje alebo urýchľuje okysličovanie, dehydrogenáciu a polymerizáciu bitúmenových reakcií.
 P4Ani10 Sa bežne používa v laboratóriách organických chémie. Autor: JDN2001CN0. Zdroj: Pixabay.
P4Ani10 Sa bežne používa v laboratóriách organických chémie. Autor: JDN2001CN0. Zdroj: Pixabay. V rafinácii paliva
Od tridsiatych rokov 20. storočia dvadsiateho storočia niektoré štúdie naznačujú, že oxid fosfor (V) vyvíjal účinok na rafináciu plynu, čím sa zvýšil jeho oktán.
Rafinácia akcie P4Ani10 Je to hlavne kvôli kondenzačným reakciám (spojenie rôznych molekúl) a nie polymerizácie (väzba rovnakých molekúl).
Môže vám slúžiť: octanu sodný: štruktúra, vlastnosti, syntéza, použitieP4Ani10 Zrýchľuje priame alomatické uhľovodíky s olefínovými uhľovodíkmi, konverzia olefínu na naftény a čiastočnú polymerizáciu. Alkylačná reakcia zvyšuje oktánový počet benzínu.
Týmto spôsobom sa získa vysoko kvalitný rafinovaný benzín.
 Niektoré deriváty oleja sa dajú zlepšiť pôsobením P4Ani10 Vo svojich molekulách. Autor: DRPEPERSCOTT230. Zdroj: Pixabay.
Niektoré deriváty oleja sa dajú zlepšiť pôsobením P4Ani10 Vo svojich molekulách. Autor: DRPEPERSCOTT230. Zdroj: Pixabay. V rôznych aplikáciách
Oxid fosfor (V) slúži:
- Pripravte kyselinu fosforečnú h3Po4
- Získajte estery akrylátu a povrchovo aktívnej látky
- Pripravte si fosfátové estery používané ako spomaľovače horenia, rozpúšťadlá a riedidlá
- Konverzia trichloridu fosforu na oxychlorid fosforu
- Laboratórne činidlo
- Vyrábajte špeciálne okuliare pre vákuové trubice
- Zvýšenie bodu topenia asfaltu
- Slúži ako štandardná molekula pri stanovení fosforu alebo fosfátov vo fosfálnej hornine, hnojivách a portlandskom cemente, vo forme P2Ani5
- Vylepšite prepojenia medzi určitými polymérmi a vrstvou slonoviny, ktoré majú zuby
 Niektoré špeciálne okuliare, ako sú vákuové trubice, musia použiť P4Ani10 Počas svojej výroby. Tvezymer [verejná doména]. Zdroj: Wikimedia Commons.
Niektoré špeciálne okuliare, ako sú vákuové trubice, musia použiť P4Ani10 Počas svojej výroby. Tvezymer [verejná doména]. Zdroj: Wikimedia Commons. Riziká
Oxid fosfor (V) sa musí udržiavať v utesnených nádobách a na čerstvých, suchých a dobre vetraných miestach.
Toto slúži na zabránenie, aby sa nekontaktovala s vodou, pretože s ňou môže prudko reagovať, vytvára veľmi teplo, do bodu spaľovania v blízkosti, ktoré sú horľavé materiály.
Prach oxidu fosforu (V) dráždi očné a dýchacie trakty a korozívne pre pokožku. Môže produkovať popáleniny v očiach. Požitím spôsobiť smrteľné vnútorné popáleniny.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Anhydrid fosforečky. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Nayler, P. (2001). Bitúmeny: upravené. Chemická úprava. V encyklopédii materiálov: veda a technológia. Zotavené z vedeckých pracovníkov.com.
- Malishev, B.W. (1936). Fosfor pentoxid ako rafinérske činidlo pre benzín. Industrial & Engineering Chemistry 1936, 28, 2, 190-193. Získané z krčiem.ACS.orgán.
- EPPS, JR. A.Do. (1950). Fotometrické stanovenie dostupného fosforu pentoxidu vo fertlizátoroch. Analytical Chemistry 1950, 22, 8, 1062-1063. Získané z krčiem.ACS.orgán.
- Banerjee, a. a kol. (1983). Použitie pentoxidu fosforu: esterifikácia organických kyselín. J. Orgán. Chem. 1983, 48, 3108-3109. Získané z krčiem.ACS.orgán.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Štvrté vydanie. John Wiley & Sons.
- Ogliari, f.Do. a kol. (2008). Syntéza fosfátových monomérov a väzby na dentín: esterifikačné metódy a použitie fosforu pentoxidu. Journal of Dentistry, Zväzok 36, vydanie 3, marec 2008, strany 171-177. Zotavené z vedeckých pracovníkov.com.
- « Hliníkový oct (AL (AL (CH3CO) 3) Štruktúra, vlastnosti, použitie
- Notácie vyvinuli, čo je, príklady a cvičenia »

