Štruktúra oxidu cínu (II), vlastnosti, nomenklatúra, použitia

- 4707
- 409
- MUDr. Žigmund Boška
On oxid cín (II) Je to kryštalická anorganická tuhá látka, ktorá je tvorená oxidáciou Tin (SN) kyslíkom, kde Tin získava Valencia 2+. Jeho chemický vzorec je SNO. Sú známe dva rôzne spôsoby tejto zlúčeniny: čierna a červená. Bežnou a najstabilnejšou formou pri izbovej teplote je modifikácia čiernej alebo čiernej modrej modifikácie.
Táto forma sa pripravuje hydrolýzou chloridu cín (II) (SNCL2) Vo vodnom roztoku, ku ktorému sa pridáva hydroxid amónny (NH4OH) na získanie zrazeniny hydratovaného oxidu od SN (II), ktorého vzorec je sno.Xh2Alebo, kde x<1 (x menor que 1).
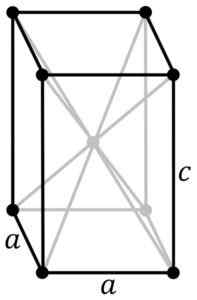 Tetragonálna kryštalická štruktúra čiernej modrej sno. Atóm SN je umiestnený v strede štruktúry a atómov kyslíka vo vrcholoch paralepiped. Original PNGS od používateľa: Rocha, vysledovaný v inkscape od používateľa: Stannered [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]] Zdroj: Wikipedia Commons
Tetragonálna kryštalická štruktúra čiernej modrej sno. Atóm SN je umiestnený v strede štruktúry a atómov kyslíka vo vrcholoch paralepiped. Original PNGS od používateľa: Rocha, vysledovaný v inkscape od používateľa: Stannered [CC BY-SA 3.0 (http: // creativeCommons.Org/licencie/By-SA/3.0/]] Zdroj: Wikipedia Commons Hydratovaný oxid je biela amorfná tuhá látka, ktorá sa potom zahrieva v suspenzii na 60-70 ° C počas niekoľkých hodín v prítomnosti NH4Ach, kým nedostanete čiernu kryštalickú čistú sno.
Červená forma SNO je metastabilná. Môže sa pripraviť pridaním kyseliny fosforečnej (h3Po4) - s 22% kyselinou fosforom, h3Po3 - A potom NH4Oh riešenie SNCL2. Získaná biela tuhá látka sa zahrieva v rovnakom roztoku na 90-100 ° C asi 10 minút. Týmto spôsobom sa získa čisto červená kryštalická SNO.
Oxid cínu (II) je východiskový materiál na výrobu iných zlúčenín CIN (II). Z tohto dôvodu je to jedna zo zlúčenín cínu, ktorá má značný obchodný význam.
Oxid cínu (II) predstavuje nízku toxicitu ako u väčšiny cínových inorganických zlúčenín. Je to kvôli ich zlej absorpcii a rýchlemu vylučovaniu živých bytostí.
Môže vám slúžiť: Bipe Beraral: Čo je, vlastnosti, čo je prePredstavuje jednu z najväčších tolerancií CIN zlúčenín v testoch vykonaných s potkanmi. Môže to však byť škodlivé, ak sa vdýchne vo veľkých množstvách.
[TOC]
Štruktúra
Oxid cín (ii) čierna modrá
Táto modifikácia kryštalizuje tetragonálnou štruktúrou. Má usporiadanie vrstvy.
Iní vedci potvrdzujú, že každý atóm SN je obklopený 5 atómami kyslíka, ktoré sú približne vo vrcholoch oktaedronu, kde šiesty vrchol je pravdepodobne obsadený párom voľných alebo nespárových elektrónov. Toto je známe ako φ-oktické usporiadanie.
Oxid červeného cínu (II)
Táto forma oxidu cínu (II) kryštalizuje orrombickou štruktúrou.
Menovanie
- Oxid cín (II)
- Oxid estany
- Oxid plechovky
- Oxid estany
Vlastnosti
Fyzický stav
Kryštalický tuhý.
Molekulová hmotnosť
134,71 g/mol.
Bod topenia
1080 ° C. Rozkladá sa.
Hustota
6,45 g/cm3
Rozpustnosť
Nerozpustné v studenej alebo horúcej vode. Nerozpustný v metanole, ale rýchlo sa rozpúšťa v kyselinách a koncentrovaných alkalis.
Ďalšie vlastnosti
Ak je viac ako 300 ° C zahrievané v prítomnosti vzduchu, oxid cínu (II) sa rýchlo oxiduje v oxidu cínu (IV), ktorý predstavuje žiarenie.
Uvádza sa, že za neoxidačných podmienok má oxid cín (II) zahrievanie rôzne výsledky podľa stupňa čistoty počiatočného oxidu. Všeobecne je neprimeraný v kovovom SN a oxidu cínu (IV), SNO2, S rôznymi strednými druhmi, ktoré sa konečne stanú SNO2.
Oxid cín (II) je amfotero, pretože sa rozpustí v kyselinách, aby poskytla sn ióny2+ alebo anióny komplexov a tiež sa rozpúšťajú v alkaloch za vzniku hydroxy-štartujúcich iónových roztokov, SN (OH)3-, ktoré majú pyramídovú štruktúru.
Môže vám slúžiť: Kyselina chlorista: vzorec, charakteristiky a použitiaOkrem toho je SNO redukčným činidlom a rýchlo reaguje s organickými kyselinami a minerálmi.
Predstavuje nízku toxicitu v porovnaní s inými cínovými soľami. Jeho DL50 (50% smrtiaca dávka alebo stredná smrteľná dávka) u potkanov je viac ako 10000 mg/kg. To znamená, že na zabitie 50% vzoriek potkanov v určitom skúšobnom období je potrebných viac ako 10 gramov na kilogram. V porovnaní s tým predstavuje fluorid cínu (II) 188 mg/kg DL50.
Ak sa však na dlhú dobu vdychuje, ukladá sa v pľúcach, pretože nie je absorbovaný a môže produkovať cín (infiltrácia prachu SNO v pľúcnych medziskupinách).
Žiadosti
Vo výrobe iných zlúčenín Tin (II)
Jeho rýchla reakcia s kyselinami je základom najdôležitejšieho použitia, ktoré je ako sprostredkovateľ pri výrobe iných cínových zlúčenín.
Používa sa pri výrobe cínového bromidu (II) (SNBR2), Cínový kyanid (II) (SN (CN)2) a hydrát s fluorobratom cín (II) (SN (bf4)2), Okrem iných cínových zlúčenín (II).
Cín fluorobora (ii) sa pripravuje rozpustením SNAM. Je to okrem iného spôsobené jeho vysokou kapacitou pokrytia.
Oxid cín (ii) sa tiež používa v príprave sulfátu cín (II) (SNSO4), podľa reakcie kyseliny SNO a sírovej, h2SW4.
SNSO4 Získaný, používa sa v konzervovanom procese na výrobu dosiek s tlačenými obvodmi, pre povrchovú úpravu elektrického kontaktu a pre kuchynské náradie.
Môže vám slúžiť: uhličitan hliník: štruktúra, vlastnosti, použitie Tlačený obvod. Nie je k dispozícii žiadny strojovo čitateľný autor. Abraham del Pozo predpokladal (na základe nárokov na autorské práva). [Verejná doména] Zdroj: Wikimedia Commons
Tlačený obvod. Nie je k dispozícii žiadny strojovo čitateľný autor. Abraham del Pozo predpokladal (na základe nárokov na autorské práva). [Verejná doména] Zdroj: Wikimedia Commons Hydratovaná forma SNO, cín Hydrotado (ii) sno.Xh2Alebo je ošetrená kyselinou fluorhoorovou, aby sa získal cínový fluorid (II), SNF2, ktorý sa pridáva do dentifrických krémov ako činidlo na boj proti zubnému kazu.
Šperky
Oxid cínu (II) sa používa pri príprave kryštálov na štrbiny zlata a medených kusov. Jeho funkciou v tejto aplikácii je zrejme pôsobiť ako redukčný činiteľ.
 Klenot s rubínom. Zdroj: Pixabay
Klenot s rubínom. Zdroj: Pixabay Iné použitia
Používa sa vo fotovoltaických zariadeniach na výrobu elektriny z svetla, napríklad solárne články.
 Fotovoltaické zariadenie. Georg Slickers [CC BY-SA 2.5 (https: // creativeCommons.Org/licencie/By-SA/2.5) Zdroj: Wikipedia Commons
Fotovoltaické zariadenie. Georg Slickers [CC BY-SA 2.5 (https: // creativeCommons.Org/licencie/By-SA/2.5) Zdroj: Wikipedia Commons Nedávne inovácie
Nanočastice upravené SNO sa používajú v elektródach s uhlíkovými nanotrubičkami pre batérie lítium-cukru.
 Nanovlákna hydrátov SNO. Fionán [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Zdroj: Wikipedia Commons
Nanovlákna hydrátov SNO. Fionán [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Zdroj: Wikipedia Commons SNO pripravené elektródy vykazujú vysokú vodivosť a malú zmenu objemu pri opakujúcich sa cykloch načítania a sťahovania.
Okrem toho SNO uľahčuje rýchly prenos iónov/elektrónov počas oxidačných redukčných reakcií, ktoré sa vyskytujú v takomto batériovom systéme.
Odkazy
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Tanec, J.C.; Emeléus, h.J.; Sir Ronald Nyholm a Trotman-Deckenson,.F. (1973). Komplexná anorganická chémia. Zväzok 2. Pergamón.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. Zväzok A27. VCH Verlagsgellschaft MBH.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Zväzok 24. Štvrté vydanie. John Wiley & Sons.
- Ostrakhovitch, Elena do. A Cherian, m. George. (2007). Konzervovať. V príručke toxikológie kovov. Tretia edícia. Zotavené z vedeckých pracovníkov.com.
- Kwestroo, w. a Vromans, P.H.G.M. (1967). Príprava troch modifikácií oxidu čistého cínu (II). J. Inorg. Nucl. Chem., 1967, zv.29, pp.2187-2190.
- Foud, s.S a kol. (1992). Optické vlastnosti tenkých filmov s oxidom. Československý denník fyziky. Február 1992, zväzok 42, vydanie 2. Zotavené z Springer.com.
- A-Young Kim a kol. (2017). Objednávané sno nanočastice v MWCNT ako funkčný hostiteľský materiál pre vysokorýchlostnú katód. Nano Research 2017, 10 (6). Zotavené z Springer.com.
- Lekárska knižnica. (2019). Oxid. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- « Jacquard Loom History, Operation, Používa sa
- Funkcionalizmus (architektúra) História, charakteristiky, diela »

