Plesanie

- 1772
- 155
- Gabriel Bahna
 Keď sa voda zahrieva v doštičke, až kým nedôjde k para, dochádza k prchavej. S licenciou
Keď sa voda zahrieva v doštičke, až kým nedôjde k para, dochádza k prchavej. S licenciou Čo je to prchanie?
Ten plesanie Je to proces premeny chemikálie kvapalného alebo tuhého stavu na plynový alebo parný. Ďalšími výrazmi, ktoré sa používajú na opis toho istého procesu, je odparovanie, destilácia a sublimácia.
Látka môže byť často oddelená od inej prchavou a môže sa obnoviť kondenzáciou pary.
Látka sa môže rýchlejšie naprchiť, buď ju zahrievať, aby sa zvýšil tlak pary alebo naparovaním, pomocou inertného plynu alebo vákuového čerpadla.
Medzi vykurovacie postupy patrí prsta.
Niekedy sa chemické reakcie používajú na výrobu prchavých produktov, ako pri uvoľňovaní oxidu uhličitého z uhličitanov, amoniaku v metóde Kjeldahl na stanovenie dusíka a oxidu siričitého pri stanovení oceľového sírov.
Prchavé metódy sa všeobecne vyznačujú veľkou jednoduchosťou a ľahkosťou prevádzky, s výnimkou prípadov, keď sú potrebné vysoko odolné voči korózii alebo sú potrebné materiály.
Tlak pary
Vedieť, že teplota varu vody je pri 100 ° C, je potrebné sa pýtať, prečo sa odparuje dažďová voda. Ak je pri 100 ° C, malo by nám to dať teplo.
Stojí za to sa tiež opýtať, čo dáva charakteristická aróma alkoholu, octu, dreve alebo plastu.
Osoba zodpovedná za toto všetko je vlastnosť známa ako tlak pary, ktorá je tlakom vyvíjaným parou v rovnováhe s pevnou alebo kvapalnou fázou tej istej látky. Čiastočný tlak látky v atmosfére na pevnej alebo kvapaline.
Tlak pary je miera tendencie materiálu meniť sa na plynný alebo parný stav, to znamená miera volatility látok.
Môže vám slúžiť: disulfid uhlíka (CS2): štruktúra, vlastnosti, použitia, rizikáKeď sa tlak pary zvyšuje, čím väčšia je kapacita kvapaliny alebo tuhej látky, takže je prchavejšia.
Tlak pary sa zvýši s teplotou. Teplota, pri ktorej sa tlak pary na povrchu kvapaliny rovná tlaku vyvíjaného prostredím, sa nazýva bod varu kvapaliny.
Tlak pary bude závisieť od rozpustenej látky rozpustenej v roztoku (je to koligatívna vlastnosť). Na povrchu roztoku (rozhranie s nízkym obsahom vzduchu) majú najvýraznejšie molekuly tendenciu odparovať sa, vymieňajú sa medzi fázami a vytvárajú tlak pary.
Prítomnosť rozpustenej látky znižuje počet molekúl rozpúšťadla na rozhraní, čím sa znižuje tlak pary.
Zmena tlaku pary sa dá vypočítať podľa Raaultovho zákona pre neprchavé látky, ktoré dajú:
(1)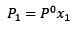 Kde p1 je tlak pary po pridaní rozpustenej látky, X1 je molárna frakcia uvedenej rozpustenej látky a p ° je tlak pary čistého rozpúšťadla.
Kde p1 je tlak pary po pridaní rozpustenej látky, X1 je molárna frakcia uvedenej rozpustenej látky a p ° je tlak pary čistého rozpúšťadla.
Ak je súčet molárnych frakcií rozpustenej látky a rozpúšťadla rovný 1, potom máme:
(2)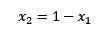
Kde x2 je molárna frakcia rozpúšťadla. Ak vynásobíme obe strany rovnice o p °, zostáva to:
(3)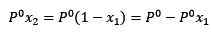
Výmena (1) v (3) zostáva:
(4)
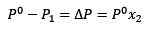
Toto je variácia tlaku pary, keď sa rozpustí rozpustenie.
Gravimetrická analýza
Gravimetrická analýza je trieda laboratórnych techník používaných na stanovenie hmoty alebo koncentrácie látky meraním zmeny hmoty.
Chemik, ktorý sa snažíme kvantifikovať, sa niekedy nazýva analyt. Gravimetrickú analýzu by sme mohli odpovedať na otázky, ako napríklad:
Môže vám slúžiť: kovové minerály- Aká je koncentrácia analytu v roztoku?
- Aká čistá je naša vzorka? Vzorka tu môže byť tuhá alebo v roztoku.
Existujú dva bežné typy gravimetrickej analýzy. Obidve zahŕňajú zmenu fázy analytu, aby sa oddelila od zvyšku zmesi, čo vedie k zmene cesta.
Jednou z týchto metód je gravimetria zrážok, ale tá, ktorá nás skutočne zaujíma, je gravimetria volatilizácie.
Gravimetria pružnosti je založená na tepelnej alebo chemickej vzorke a zmerajte výslednú zmenu jej hmoty.
Prípadne môžeme chytiť a zvážiť prchavý produkt rozkladu. Pretože uvoľňovanie prchavého druhu je nevyhnutnou súčasťou týchto metód, kolektívne ich klasifikujeme ako gravimetrické metódy analýzy analýzy volatilizácie.
Problémy s gravimetrickou analýzou sú jednoducho problémami stechiometrie s niekoľkými ďalšími krokmi.
Na vykonanie akéhokoľvek stechiometrického výpočtu potrebujeme koeficienty vyváženej chemickej rovnice.
Napríklad, ak vzorka obsahuje nečistoty dihydratovaného bária (BACL2● H₂o), môžete získať množstvo nečistôt zahrievaných vzorky na odparovanie vody.
Hmotnostný rozdiel medzi pôvodnou vzorkou a zahrievanou vzorkou nám dá v gramoch množstvo vody obsiahnutej v chloridu bária.
S jednoduchým stechiometrickým výpočtom sa získa množstvo nečistôt vzorky.
Frakčná destilácia
Frakčná destilácia je proces, ktorým sú komponenty kvapalnej zmesi rozdelené na rôzne časti (nazývané frakcie) podľa ich rôznych bodov varu.
Rozdiel volatility zlúčenín zmesi hrá základnú úlohu pri jej oddelení.
Môže vám slúžiť: oktetové pravidloFrakčná destilácia sa používa na čistenie chemikálií a tiež na oddelenie zmesí a na získanie ich komponentov. Používa sa ako laboratórna technika av priemysle, kde má tento proces veľký komerčný význam.
Výpary roztoku vriaceho sa prenášajú pozdĺž vysokého stĺpca, nazývaného stĺpca subdivízie.
Stĺpec je balený plastovými alebo sklenenými perlami na zlepšenie separácie, čo poskytuje väčšiu plochu na kondenzáciu a odparovanie.
Teplota kolóny postupne klesá pozdĺž svojej dĺžky. Komponenty s vyšším bodom varu sú v stĺpci kondenzované a vrátia sa do roztoku.
Komponenty dolných bodov varu (prchavejšie) prechádzajú stĺpcom a zhromažďujú sa blízko vrcholu.
Teoreticky má viac perál alebo dosiek zlepšuje separáciu, ale pridanie dosiek tiež zvyšuje čas a energiu potrebnú na dokončenie destilácie.
Príklad
- Blok suchého ľadu v kontakte so prasknutím vzduchu. Vzduch začína proces prchavosti a ľad sa odparuje: prechádza z tuhého stavu na sódu.
- Keď sa varí voda alebo iná látka: teplo vytvára paru, a tak voda prechádza z kvapalného stavu do plynného.
- Naftalínové tablety, ktoré postupne degradujú a prechádzajú z pevného stavu do sódy.
- Ak je pevná síra vystavená vysokým teplotám, stáva sa toxickými plynmi. To znamená, že ide z pevných na plynný.
- Aromatizačné pilulky: Majú rovnaký proces ako naftalínové tablety, postupne degradujú a stávajú sa plynovým, zápachom a neškodným.
Odkazy
- Definícia tlaku pary. Zotavené z Thoughtco.com.
- Tlak pary. Zotavené z Britannice.com.

