História volfrámu, vlastnosti, štruktúra, použitie

- 3183
- 450
- Alan Milota
On volfrám, Wolframio alebo Volframium je ťažký prechodný kov, ktorého chemický symbol je w. Nachádza sa v období 6 so skupinou 6 periodickej tabuľky a jeho atómové číslo je 74. Jeho meno má dva etymologické významy: Hard Stone a Wolf Pena; Druhým je, že tento kov je známy aj ako Wolframio.
Je to strieborný šedý kov a aj keď je krehký, má veľkú tvrdosť, hustotu a vysoké fúzie a body varu. Preto sa používa vo všetkých tých aplikáciách, ktoré zahŕňajú vysoké teploty, tlaky alebo mechanické sily, ako sú vŕtačky, projektily alebo vlákna vyžarujúce žiarenie.
 Volfrámová tyčinka s čiastočne oxidovaným povrchom. Zdroj: Hi-RES obrázky chemických prvkov [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]
Volfrámová tyčinka s čiastočne oxidovaným povrchom. Zdroj: Hi-RES obrázky chemických prvkov [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)] Najznámejšie použitie pre tento kov, na kultúre a populárnej úrovni, je vo vláknach elektrických žiaroviek. Kto s nimi manipuloval, si uvedomí, aké krehké sú; Nie sú však vyrobené z čistého volfrámu, ktorý je kmotný a ťažný. Okrem toho v kovových matrici, ako sú zliatiny, poskytuje vynikajúcu odolnosť a tvrdosť.
Vyznačuje sa a vyznačuje sa tým, že je kovom s najvyšším bodom fúzie a za to, že je tiež hustejší ako ten istý náskok, prekonaný iba inými kovmi, ako sú Osmium a Iridium. Je to tiež najťažší kov, o ktorom je známe, že v tele stretáva biologickú úlohu.
Vo väčšine svojich iónových zlúčenín sa volfátový anión zúčastňuje, wo42-, ktoré môžu polymerizovať, aby spôsobili zhluky v kyslom médiu. Na druhej strane, volfrán môže tvoriť intermetalické zlúčeniny alebo steterizovať s kovmi alebo anorganickými soľami, aby ich tuhé látky získali rôzne formy alebo konzistencie.
V zemskej kôre to nie je veľmi hojné, pretože z toho má len 1,5 gramu tohto kovu. Okrem toho, pretože je to ťažký prvok, jeho pôvod je medzigalaktický; Konkrétne výbuchov supernov, ktoré museli počas ich formácie hádzať „trysky“ atómov volfrámu na našu planétu.
[TOC]
História
Etymológia
História volfrámu alebo Wolframio má dve tváre, ako aj ich mená: jeden švajčiarsky a druhý nemecký. V 16. storočí v regiónoch, ktoré v súčasnosti obsadzujú Nemecko a Rakúsko.
Dovtedy sa baníci v tomto procese stretli s tŕňom: bol extrémne náročný minerál; Minerál pozostával z Wolframitu (Faith, Mn, Mg) Wo4, ktorá si zachovala alebo „zožlala“ plechovku, akoby to bol vlk.
Preto etymológia tohto prvku, „vlk“ vlku v španielčine, vlk, ktorý jedol cín; a „Ram“ z peny alebo smotany, ktorého kryštály pripomínali dlhú čiernu kožušinu. Bolo to tak, že na počesť týchto prvých pozorovaní sa objavilo meno „Wolfram“ alebo „Wolframio“.
V roku 1758, na švajčiarskej strane k podobnému minerálu, Scheelita, Cawo4, Bol pomenovaný „Tung Sten“, čo znamená „tvrdý kameň“.
Obidve mená, Wolframio a volfrám, sa všeobecne používajú zameniteľne, v závislosti výlučne na kultúre. Napríklad v Španielsku a na európskom západe je tento kov známy viac Wolframio; Zatiaľ čo na americkom kontinente prevláda meno volfrámu.
Uznanie a objav
Potom bolo známe, že medzi sedemnástym a osemnástym storočím boli dva minerály: Wolframit a Scheelita. Ale kto sa pozrel na to, že existuje iný kov ako ostatní? Dalo sa charakterizovať iba ako minerály a v roku 1779 írsky chemik Peter Woulfe starostlivo analyzoval Wolframit a odvodil existenciu Wolframium.
Môže vám slúžiť: Kyselina perbromová (HBRO4): Vlastnosti, riziká a použitiaNa švajčiarskej strane opäť Carl Wilhelm Scheele v roku 1781 dokázal izolovať volfrámu ako wo3; A ešte viac, získal tumatickú (alebo Wolfram) kyselinu, h2Hanba4 a ďalšie zlúčeniny.
To však nestačilo na dosiahnutie čistého kovu, pretože bolo potrebné znížiť túto kyselinu; to znamená, že ho vystavuje takým procesom, ktorý nebude schopný kyslík a kryštalizovať ako kov. Carl Wilhelm Scheele nemal vhodnú metodiku pre túto chemickú redukčnú reakciu.
To je miesto, kde španielski bratia D'Aluyar, Fausto a Juan José, ktorí znížili obidve minerály (Wolframit a Scheelita) s uhlím v meste Bergara v meste Bergara. Dvaja sú udelené zásluhy a česť byť objaviteľmi Wolframium alebo kovového volfrámu (W).
Ocele a žiarovky
 Akákoľvek žiarovka s volfrámovým vláknom. Zdroj: pxhere.
Akákoľvek žiarovka s volfrámovým vláknom. Zdroj: pxhere. Rovnako ako iné kovy, aj jeho použitia definujú svoju históriu. Medzi najvýznamnejšie do konca 19. storočia boli zliatiny oceľ-tungsten a vlákna volfrámu, ktoré nahradia uhlík vo vnútri elektrických žiaroviek. Dá sa povedať, že prvé žiarovky, ako ich poznáme, boli uvedené na trh v rokoch 1903-1904.
Vlastnosti
Fyzický vzhľad
Je to strieborný a lesklý šedý kov. Krehké, ale veľkej tvrdosti (nie mätúce s húževnatosťou). Ak je kus vysokej čistoty, stáva sa kladiteľným a tvrdým, oboje alebo viac a niekoľko ocelí.
Atómové číslo
74.
Molárna hmota
183,85 g/mol.
Bod topenia
3422 ° C.
Bod varu
5930 ° C.
Hustota
19,3 g/ml.
Fúzne teplo
52,31 kJ/mol.
Odparovanie
774 kj/mol.
Kapacita moláru
24,27 kJ/mol.
MOH tvrdosť
7.5.
Elektronegativita
2,36 v Pauling Scale.
Atómové rádio
139 hod
Elektrický odpor
52.8 NΩ · m pri 20 ° C.
Izotopy
Predovšetkým predstavuje v prírode ako päť izotopov: 182W, 183W, 184W, 186W a 180W. Podľa molárnej hmotnosti 183 g/mol, ktorá v priemere atómové hmotnosti týchto izotopov (a ďalších tridsať rádioizotopov), má každý atóm volfrámu alebo wolframu asi sto a desať neutrónov (74 + 110 = 184).
Chémia
Je to vysoko odolný voči koróznému kovu, ako jeho tenká vrstva WO3 chráni ho pred útokom kyslíka, kyseliny a alkalis. Po rozpustení a vyzrážanom s inými činidlami sa získajú ich soli, ktoré sa nazývajú wolframáty alebo volbe; V nich má volfrám oxidačný stav +6 (za predpokladu, že existujú katióny w6+).
Zoskupovanie kyselín
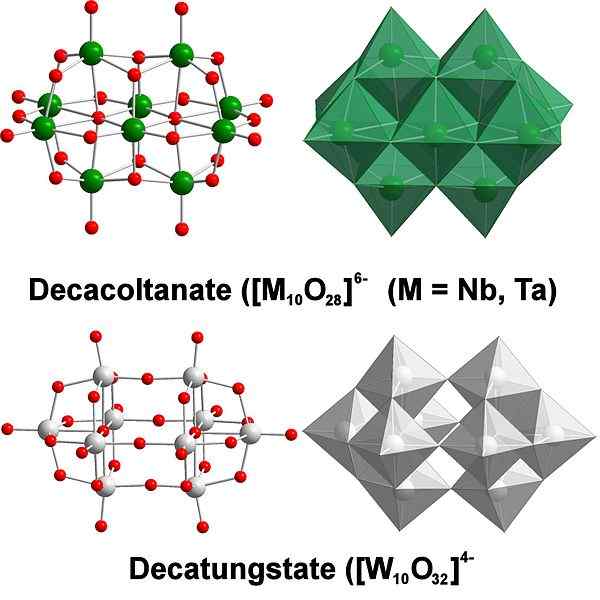 Decatungstate, príklad volfrámových polyaxometalátov. Zdroj: Scifanz [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Decatungstate, príklad volfrámových polyaxometalátov. Zdroj: Scifanz [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Chemicky je volfrám dosť zvlášť, pretože jeho ióny majú tendenciu byť zoskupené (zoskupovanie v angličtine), aby tvorili heteropolycidy alebo polyaxometalát. Čo sú zač? Sú to skupiny alebo zhluky atómov, ktoré sa viažu na definovanie trojrozmerného tela; Hlavne jedna so štruktúrou sférickej klietky, v ktorej „uzatvárajú“ ďalší atóm.
Všetko to začína od voltačného aniónu, wo42-, Ktoré je v kyslom médiu protónované (hwo4-) a spojené so susedným aniónom, ktorý sa vytvára [w2Ani7(Oh)2]2-; A to sa zase pripojí k inému [w2Ani7(Oh)2]2- Na pôvod [W4Ani12(Oh)4]4-. Takže do roztoku existuje niekoľko polytungstates.
Môže vám slúžiť: chlorid lítium (LICL): vlastnosti, riziká a použitiaParathungstate A a B, [W7Ani24]6- a h2W12Ani4210-, sú jedným z najvýznamnejších z týchto polyádov.
Môže sa stať výzvou zvážiť jeho náčrt a Lewisove štruktúry; Ale v zásade je dosť na ich vizualizáciu, keď sa sady Wo Octaedra sady6 (horný obrázok).
Všimnite si, že tieto šedivé oktaedra nakoniec definujú Decatungstate, Politungstate; Ak sa vo vnútri uzamkne heteroátomo (napríklad fosfor), potom by to bol polyaxometalát.
Elektronická štruktúra a konfigurácia
Kryštalické fázy
Volfrámové atómy definujú kubickú štruktúru sústredenú na telo (bcc, Kubický). Táto kryštalická forma je známa ako fáza a; Zatiaľ čo β fáza je tiež kubická, ale trochu hustá. Obe fázy alebo kryštalické formy, a a p, môžu existovať v rovnováhe za normálnych podmienok.
Kryštalické zrná vo fáze a sú izometrické, zatiaľ čo zrnko β fázy sa podobajú stĺpcom. Bez ohľadu na to, ako je sklo, v tomto vládnu. V opačnom prípade nebolo možné vysvetliť vysoké body topenia a varu, alebo vysokú tvrdosť a hustotu volfrámu.
Kovový odkaz
Atómy volfrámu musia byť nejako veľmi zjednotené. Na zvýšenie dohady by sa mala dodržiavať elektronická konfigurácia tohto kovu skôr:
[Xe] 4f145 D46s2
5D orbitály sú veľmi veľké a rozmazané, čo by znamenalo, že medzi dvoma blízkymi atómami w sú účinné orbitálne prekrývanie. Orbitály 6s tiež prispievajú k výsledným pásmom, ale v menšej miere. Zatiaľ čo orbitály 4F majú „veľmi hlboko dole“ a ich príspevok k kovovému spojeniu je nižší.
Toto, veľkosť atómov a kryštalické zrná, sú premenné, ktoré určujú tvrdosť volfrámu a jeho hustotu.
Oxidačné stavy
V volfrámoch alebo kovovom wolframium majú atómy w nulová oxidačná stav (w0). Po návrate do elektronickej konfigurácie môžu orbitály 5D a 6S „vyprázdniť“ elektróny v závislosti od toho, či je W v spoločnosti veľmi elektronegatívnych atómov, ako je kyslík alebo fluór.
Keď sa stratia dva 6S elektróny, volfrám má oxidačný stav +2 (w2+), Čo generuje túto zmluvu o atóme.
Ak tiež stratíte všetky elektróny vašich 5D orbitálov, váš stav oxidácie sa stane +6 (w6+); Odtiaľ sa nemôže stať pozitívnejším (teoreticky), pretože orbitály 4F za interné by si vyžadovali veľké energie na odstránenie svojich elektrónov. To znamená, že najpozitívnejším oxidačným stavom je +6, kde má volfrár ešte malý.
Tento volfrám (VI) je veľmi stabilný v kyslých podmienkach alebo v mnohých okysličených alebo halogénovaných zlúčeninách. Ďalšie pozitívne a možné oxidačné stavy sú: +1, +2, +3, +4, +5 a +6.
Volfrám môže tiež získať elektróny, ak je kombinovaný s menšími elektronickými atómami ako on. V tomto prípade sa ich atómy zväčšujú. Môže získať maximálne štyri elektróny; to znamená, že máte oxidačný stav -4 (w4-).
Získanie
Predtým sa zmienilo, že volfrám sa nachádza vo mineráloch Wolframite a Scheelita. V závislosti od procesu sa z nich získajú dve zlúčeniny: oxid volfrámu, wo3, alebo amónny paratungstate (NH4)10(H2W12Ani42) · 4h2O (alebo ATP). Každý z nich je možné zredukovať na kovový w s uhlím nad 1050 ° C.
Môže vám slúžiť: Raault Law: Princíp a vzorec, príklady, cvičeniaNie je to ekonomicky ziskové. Preto je uprednostňované, aby ste ho vyrábali vo forme prachu, aby sa raz vysporiadali s inými kovmi, aby sa získali zliatiny.
Za zmienku stojí, že svet Číny je krajinou s najväčšou produkciou volfrámu. A na americkom kontinente, Kanade, Bolívii a Brazílii tiež zaberajú zoznam najväčších výrobcov tohto kovu.
Žiadosti
 Zlúčenina z karbidu volfrámu: Príklad toho, ako možno tvrdosť tohto kovu použiť na zvodnutie a stvrdnutie materiálov. Zdroj: SolitaryAngel (SolitaryAngel) [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Zlúčenina z karbidu volfrámu: Príklad toho, ako možno tvrdosť tohto kovu použiť na zvodnutie a stvrdnutie materiálov. Zdroj: SolitaryAngel (SolitaryAngel) [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Niektoré zo známych použití tohto kovu sú uvedené nižšie:
-Jeho soli boli použité na vyfarbenie bavlníkových divadiel outfit.
-V kombinácii s oceľou stvrdne ešte viac, dokonca aj schopný odolávať mechanickým rezom pri vysokých rýchlostiach.
-Volfrámové spekanie sa používa už viac ako sto rokov v elektrických žiarovkách a halogenovaných žiarovkách. Aj kvôli svojmu vysokému bodu topenia slúžil ako materiál pre trubice katódového lúča a pre raketové motory dýzy.
-Nahrádza olovo pri výrobe projektilov a rádioaktívnych štítov.
-Volfrámové nanokábiky sa môžu použiť v nanodistibilných nanodistitívnych na pH.
-Na riešenie výroby síry v ropnom priemysle boli použité volfrámové katalyzátory.
-Volfrámový karbid je zo všetkých jeho zlúčenín, ktorý pokrýva viac použitia. Z posilnenia rezu a vŕtacích nástrojov alebo výroby kusov vojenských zbrojov, aby sa mechanizovali drevo, plasty a keramika.
Riziká a preventívne opatrenia
Biologický
Keďže je relatívne zriedkavý kov v zemskej kôre, jeho negatívne účinky sú vzácne. V kyslých pôdach nemusia polytungstaty ovplyvniť enzýmy používané molybdatami; Ale v základných pôdach, wo42- Zasahuje (pozitívne alebo negatívne) do metabolických procesov Moo42- a meď.
Napríklad rastliny môžu absorbovať rozpustné zlúčeniny volfrámu a ich jedením zvieraťa a potom po konzumácii svojho mäsa vstupujú atómy W atómy na naše organizmy. Väčšina z nich je vylúčená močom a výkaly a málo je známe, čo sa stane s ostatnými z nich.
Štúdie na zvieratách ukázali, že keď sa vysoké koncentrácie volfrámového prášku vyvinú príznaky podobné rakovine pľúc.
Požitím by dospelý človek musel piť tisíce galónov vody obohatených volfrámovými soľami, aby sa preukázala výrazná inhibícia enzýmov kolinesterázy a fosfatázy.
Fyzický
Voltrova je všeobecne trochu toxický prvok, a preto existuje len málo rizík hostiteľa pre škody na zdraví.
Pokiaľ ide o kovový volfrám, mali by ste sa vyhnúť dýchaniu jeho prachu; A ak je vzorka pevná, treba sa zohľadniť, že je veľmi hustá a že môže spôsobiť fyzické poškodenie, ak padne alebo zasiahne iné povrchy.
Odkazy
- Zvonenie. (s.F.). Volfrám (Wolfram): Vlastnosti, výroba, aplikácie a zliatiny. Rovnováha. Získané z: Thebalance.com
- Wikipedia. (2019). Volfrám. Zdroj: In.Wikipedia.orgán
- Šošovica B.Vložka. (2019). Volfrám. Získané z: Lentech.com
- Jeff Desjardins. (1. mája 2017). História volfrámu, najsilnejší prírodný kov na Zemi. Obnovené z: vizuálneho kapitalistického.com
- Doug Stewart. (2019). Fakty volfrámového prvku. Získané z: Chemicool.com
- Art Fisher a Pam Powell. (s.F.). Volfrám. University of Nevada. Uzdravené z: Unce.r.Edu
- HelMestine, Anne Marie, PH.D. (2. marca 2019). Volfrám alebo Wolfram. Zotavené z: Thoughtco.com

