Tronínové charakteristiky, funkcie, degradácia, výhody
- 1587
- 315
- Alan Milota
Ten Treonina (Thr, T) alebo Treo-a-amino-pi-butylová kyselina je jednou z konštitučných aminokyselín bunkových proteínov. Pretože človek a iné zvieratá stavovcov nemajú na svoju výrobu biosyntetické trasy, treonín sa považuje.
Treonín bol posledným z 20 bežných aminokyselín objavených v proteínoch, čo sa odohralo v histórii viac ako storočie po objavení asparagínu (1806), ktorá bola prvou opísanou aminokyselinou opísanou.
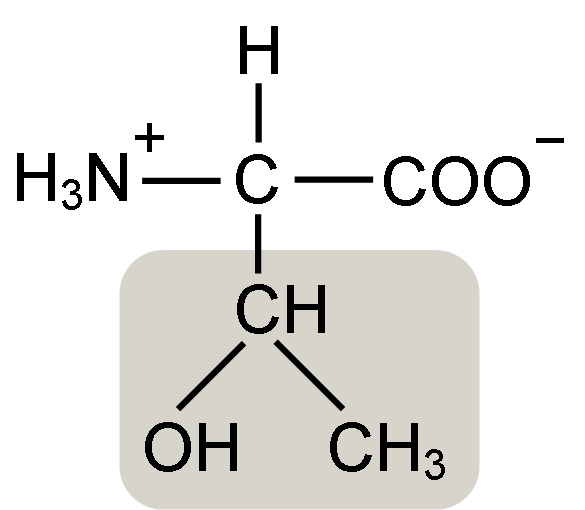
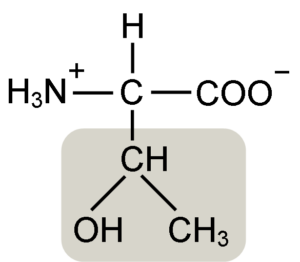 Štruktúra aminokyselinovej aminokyseliny (zdroj: Keycin [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Štruktúra aminokyselinovej aminokyseliny (zdroj: Keycin [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Objavil ho William Cumming Rose v roku 1936, ktorý vytvoril termín „treonín“ pre štrukturálnu podobnosť, ktorú našiel medzi touto aminokyselinou a kyselinou haraónovou, zlúčeninou odvodenou z treózového cukru.
Ako aminokyselinový proteín má v bunkách treonín viac funkcií, medzi ktorými je väzbové miesto pre sacharidové reťazce typické pre glykoproteíny a vyniká rozpoznávacie miesto pre proteínkinázy so špecifickými funkciami (treonínové proteíny/serínové kinázy)).
Podobne je treonín nevyhnutnou súčasťou proteínov, ako je zubná sklovina, elastín a kolagén, a má tiež dôležité funkcie v nervovom systéme. Používa sa ako doplnok potravín a ako „zmierňovač“ fyziologických stavov úzkosti a depresie.
[TOC]
Charakteristika
Treonín patrí do skupiny polárnych aminokyselín, ktorá má skupinu R alebo bočný reťazec bez pozitívneho alebo negatívneho zaťaženia (nepodalné polárne aminokyseliny).
Charakteristiky jej skupiny R sú vyrobené vysoko rozpustnou aminokyselinou (hydrofilnou alebo hydrofilnou), čo platí aj pre ostatných členov tejto skupiny, ako je cysteín, serín, asparagín a glutamín.
Spolu s tryptofánom, fenylalanínom, izoleucínom a tyrozínom je treonín jednou z piatich aminokyselín, ktoré majú glukogénne aj ketogénne funkcie, pretože z jeho metabolizmu existujú relevantné sprostredkovateľov, ako je pyruvát a sukcinyl-coA.
Táto aminokyselina má približnú molekulovú hmotnosť 119 g/mol; Rovnako ako mnoho aminokyselín bez zaťaženia, má okolo 5 izoelektrický bod.87 a jeho frekvencia v proteínových štruktúrach je takmer 6%.
Niektorí autori zoskupujú treonín spolu s ďalšími aminokyselinami „sladkej“ chuti, medzi ktorými patria napríklad serín, glycín a alanín.
Štruktúra
A-aminokyseliny, ako je treonín, majú všeobecnú štruktúru, to znamená, že je bežná pre všetkých. Toto sa vyznačuje prítomnosťou atómu uhlíka známeho ako „α uhlík“, ktorý je chirálny a ku ktorému sú spojené štyri typy molekúl alebo rôznych substituentov.
Tento uhlík zdieľa jednu zo svojich väzieb s atómom vodíka, ďalšia so skupinou R, ktorá je charakteristická pre každú aminokyselinu, a ďalšie dve sú obsadené aminokybíkmi (NH2) a karboxylom (COOH), ktoré sú bežné pre všetkých Aminokyseliny.
Tonínová skupina R má hydroxylovú skupinu, ktorá jej umožňuje tvoriť vodíkové mosty s inými molekulami vo vodnom médiu. Jeho identitu možno definovať ako alkoholická skupina (etanol s dvoma atómami uhlíka), ktorá stratila jeden z jeho vodíkov, aby sa pripojila k a (-chah-ch3) uhlíkovému atómu.
Táto skupina -OH môže slúžiť ako „most“ alebo miesto únie pre rôzne molekuly (je možné sa pripojiť, napríklad oligosacharidové reťazce počas tvorby glykoproteínov), takže je jedným z tých, ktorí sú zodpovední za tvorbu tvorby modifikované deriváty treonínu.
Biologicky aktívna forma tejto aminokyseliny je L-treonín a je to tak, že sa podieľa na tvorbe proteínových štruktúr, ako aj na rôznych metabolických procesoch, kde pôsobí.
Funkcia
Ako aminokyselinový proteín je treonín súčasťou štruktúry mnohých proteínov v prírode, kde jeho dôležitosť a bohatstvo závisia od identity a funkcie proteínu, ku ktorému patrí.
Môže vám slúžiť: heteróza: zlepšenie zvierat, v rastlinách, ľudskej bytostiOkrem svojich štrukturálnych funkcií pri tvorbe peptidovej sekvencie proteínov, treonín plní ďalšie funkcie v nervovom systéme aj v pečeni, kde sa podieľa na metabolizme tukov a zabraňuje jeho akumulácii v tomto orgáne v tomto orgáne.
Treonín je súčasťou sekvencií rozpoznávaných enzýmami kinázovými kinázami, ktoré sú zodpovedné za početné procesy fosforylácie proteínov, ktoré sú nevyhnutné pre reguláciu multiplicity funkcií a intracelulárnych signalizačných udalostí.
Používa sa tiež na liečbu niektorých črevných a tráviacich porúch a jej užitočnosť pri útlóch patologických stavov, ako je úzkosť a depresia.
L-Treonín je tiež jednou z aminokyselín potrebných na udržanie pluripotentného stavu myších embryonálnych kmeňových buniek, čo je skutočnosť, ktorá zjavne súvisí s metabolizmom S-adenozyl-metonínu a metylačnými udalosťami histónov, ktoré sú priamo zapojený do expresie génov.
V priemysle
Spoločnou vlastnosťou pre mnoho aminokyselín je jej schopnosť reagovať s inými chemickými skupinami, ako sú aldehydy alebo ketóny na tvorbu charakteristických „príchutí“ mnohých zlúčenín.
Medzi týmito aminokyselinami je treonín, ktorý ako serín reaguje s sacharózou počas TOS.
Treonín je prítomný v mnohých liekoch prírodného pôvodu a tiež v mnohých formuláciách výživových doplnkov, ktoré sú predpísané pacientom s podvýživou alebo majú v tejto aminokyseline zlú stravu.
Ďalšia z najznámejších funkcií L-Treonínu a ktorá v priebehu času rastie, je prídavná pri príprave koncentrovaného potravín pre ošípané a priemysel výroby hydiny.
L-Treonín sa v týchto odvetviach používa ako doplnok potravín v slabých formuláciách z hľadiska bielkovín, pretože to poskytuje ekonomické výhody a zmierňuje surové nedostatky bielkovín, ktoré tieto hospodárske zvieratá konzumujú.
Hlavnou formou výroby tejto aminokyseliny je normálne údaje o mikrobiálnej fermentácii a svetovej výrobe na poľnohospodárske účely za rok 2009 prekročili 75 ton.
Biosyntéza
Treonín je jednou z deviatich esenciálnych aminokyselín pre človeka, čo znamená, že ho nemožno syntetizovať telesnými bunkami, a preto sa musí získať z proteínov živočíšneho alebo rastlinného pôvodu, ktoré sú dodávané s dennou stravou.
Rastliny, huby a baktérie syntetizujú treonín z podobných trás, ktoré môžu navzájom predstavovať niektoré nezrovnalosti. Väčšina z týchto organizmov však začína od Asparta ako predchodcu nielen pre treonín, ale aj pre metódu a lyzínu.
Biosintetická cesta v mikróboch
Biosyntéza trasy L-tronínu v mikroorganizmoch, ako sú baktérie, pozostáva z piatich krokov katalyzovaných rôznymi enzýmami. Odchodový substrát, ako bolo komentované, je aspartát, ktorý je fosforylovaný enzýmom ATP-závislým quinasa aspartátom.
Táto reakcia produkuje metabolit L-asfat fosfát (L-Aspartil-P), ktorý slúži ako substrát pre semiádehydic aspartyl enzým dehydrogenázu, ktorý katalyzuje jeho konverziu na polo-závislú semi-závislú aspartyl enzým.
Semiiardhaide Aspartyl sa môže použiť tak na biosyntézu L-lisínu, ako aj na biosyntézu L-treonínu; V tomto prípade sa molekula používa závislá od homoserínovej enzýmu NADPH na výrobu L-homoserina.
L-homoserín je fosforylovaný na L-homoserín fosfát (L-Homoserina-P) homoserínom ATP-závislým kinázou a uvedený reakčný produkt zase je substrátom syntázy treonínového enzýmu, ktorý je schopný syntetizujúceho L-triníny L-triníny.
L-metonín sa dá syntetizovať z L-homoserínu produkovaného v predchádzajúcom kroku, takže predstavuje „konkurenčnú“ cestu pre syntézu L-Treonine.
Syntetizovaný L-treonín týmto spôsobom sa môže použiť na syntézu proteínov alebo sa môže použiť aj na syntézu glycínu a L-leucínu, dve relevantné aminokyseliny tiež z proteínového hľadiska.
Môže vám slúžiť: evolučné teórieRegulácia
Je dôležité zdôrazniť, že tri z piatich enzýmov, ktoré sa zúčastňujú na biosyntéze L-treonínu v baktériách, sú regulované produktom reakcie negatívnou spätnou väzbou. Jedná sa o kinázový aspartát, homoseríndehydrogenáza a homoserínkináza.
Okrem toho regulácia tejto biosyntetickej trasy tiež závisí od bunkových požiadaviek ostatných biosyntetických produktov súvisiacich s ňou, pretože tvorba L-lizín, L-metionín, L-izoleucínu a glycínu závisí od výrobnej cesty výroby výroby L-Treonine.
Degradácia
Treonín je možné degradovať dvoma rôznymi trasami na výrobu pyruvátu alebo sukcinyl-coA. Ten je najdôležitejším produktom treonínového katabolizmu u ľudí.
Metabolizmus treonínu sa vyskytuje hlavne v pečeni, ale pankreas, hoci v menšej miere, sa tiež zúčastňuje na tomto procese. Táto trasa začína transportom aminokyseliny cez plazmatickú membránu hepatocytov pomocou špecifických transportérov.
Produkcia pyruvátu z Treonine
Konverzia treonínu na pyruvát sa vyskytuje vďaka jeho transformácii na glycín, ktorý sa odohráva v dvoch katalytických krokoch, ktoré začínajú tvorbou 2-amino-3-ekotobutirátu z treonínu a pôsobením enzýmovej treonínovej dehydrogenázy.
V ľudskej bytosti táto cesta predstavuje iba medzi 10 a 30% katabolizmu treonínu, ale jej dôležitosť je relatívna k organizmu, ktorý sa považuje za napríklad u iných cicavcov.
Produkcia Succinil-CoA z Treonina
Rovnako ako v prípade metócie, Valina a izoleucínu, atómy uhlíka treonínu sa tiež používajú na výrobu sukunilných-CoA. Tento proces začína konverziou aminokyseliny na a-cethobutirát, ktorý sa následne používa ako substrát enzýmu a-Zo-utlaka dehydrogenázy na vykonanie propionil-coA.
Transformácia treonínu na a-cethobutirát je katalyzovaná enzýmovou dehydratázou, čo znamená stratu molekuly vody (H2O) a ďalší z amoniakových iónov (NH4+).
Propionyl-CoA je karboxylovaný v metylmalonyl-CoA prostredníctvom dvojkrokovej reakcie, ktorá vyžaduje vstup atómu uhlíka bikarbonátu (HCO3-). Tento produkt slúži ako substrát pre metyllmalonil-coA mutasa-koenzým B12 závislý, ktorý „epimerizuje“ molekulu na produkciu sukcinyl-CoA.
Ostatné katabolické výrobky
Okrem toho sa uhlíková kostra treonínu môže katabolicky použiť na výrobu acetyl-CoA, ktorá má tiež dôležité dôsledky z energetického hľadiska v telesných bunkách.
V určitých organizmoch funguje treonín tiež ako substrát niektorých biosyntetických trás, ako je izoleucín. V tomto prípade môže byť prostredníctvom 5 katalytických krokov a-ecthobutirát odvodený od katabolizmu treonínu smerovať k tvorbe izoleucín.
Potraviny bohaté na treonine
Aj keď väčšina bohatých potravín v bielkovinách má určité percento všetkých aminokyselín, bolo stanovené, že vajcia, mlieko, sójová a želatína sú obzvlášť bohaté na aminokyselinu treonínu.
Treonine je tiež v živočíšnom mäse, ako je kuracie mäso, prasa, králik, jahňacie mäso a rôzne druhy vtákov. V potravinách rastlinného pôvodu je hojný v chóloch, na cibule, cesnaku, mangoldingu a baklažánoch.
Nachádza sa tiež v ryži, kukurici, pšeničných otrukoch, strukových zrnách a v mnohých ovociach, ako sú jahody, banány, hrozno, ananás, slivky a iné orechy bohaté na bielkoviny, ako sú orechy alebo pistácie, okrem iného.
Výhody vášho príjmu
Podľa Výboru odborníkov Svetovej zdravotníckej organizácie pre poľnohospodárstvo a jedlo (WHO, FAO), denná požiadavka Treoniny pre priemernú dospelú ľudskú bytosť je okolo 7 mg na kilogram telesnej hmotnosti, ktorá sa musí získať z potravy požitého stravou.
Môže vám slúžiť: červená fenol: Charakteristiky, príprava, aplikácieTieto čísla vyplývajú z experimentálnych údajov získaných zo štúdií vykonaných s mužmi a ženami, kde toto množstvo treonínu je dostatočné na získanie pozitívnej rovnováhy dusíka v telesných bunkách.
Štúdie s deťmi vo veku 6 mesiacov a jeden rok však ukázali, že pre nich sú minimálne požiadavky L-treonínu medzi 50 a 60 mg na kilogram hmotnosti za deň.
Medzi hlavné výhody príjmu výživových doplnkov alebo liekov so špeciálnymi formuláciami bohaté na L-treonín patrí liečba laterálnej amyotropnej sklerózy alebo choroby Lou Gehrig.
Ďalšie dodávky treonínu uprednostňuje absorpciu živín v čreve a tiež prispieva k zlepšeniu funkcií pečene. Je tiež dôležitý pre transport fosfátových skupín cez bunky.
Poruchy nedostatku
U malých detí sa rodia defekty v metabolizme treonínu, ktoré spôsobujú oneskorenie rastu a ďalšie súvisiace metabolické poruchy.
Nedostatky v tejto aminokyseline boli spojené s niektorými zlyhaniami pri prírastke hmotnosti dieťaťa, okrem iných patológií súvisiacich s nedostatkom retencie dusíka a jeho stratou v moči.
Ľudské bytosti vystavené chudobnej strave v Treonine môžu mať väčšiu sklonu trpieť mastnou pečeňou a niektorými črevnými infekciami súvisiacimi s touto aminokyselinou.
Odkazy
- Barret, G., & Elmore, D. (2004). Aminokyseliny a peptidy. Cambridge: Cambridge University Press.
- Borgonha, s., Regan, m. M., Ach s. H., Condon, m., & Young, V. R. (2002). Požiadavka treonínu zdravých dospelých, dodávaných technikou vyváženia aminokyselín s indikátorom 24 hodín. American Journal of Clinical Nutrition, 75(4), 698-704.
- Bradford, h. (1931). História objavu aminokyselín. Ii. Prehľad aminokyselín opísaný od roku 1931 ako zložky natívnych proteínov. Pokroky v proteínovej chémii, 81-171.
- Champe, P., & Harvey, r. (2003). Aminokyseliny aminokyseliny. V Ilustrované recenzie Lippincott: Biochémia (3. Ed., pp. 1-12). Lipincott.
- De Lange, C. F. M., Gillis, a. M., & Simpson, G. J. (2001). Vplyv príjmu treonínu na depozíciu proteínov koho tela a využitie treonínu pri pestovaní ošípaných kŕmených purifikovanou stravou. Journal of Animal Science, 79, 3087-3095.
- Edelman, a., Blumenthal, D., & Krebs a. (1987). Serín/treonínkináza proteín. Anu. Otáčať sa., 56, 567-613.
- Edsall, J. (1960). Aminininokyseliny, proteíny a biochémia rakoviny (Zv. 241). Londýn: Academic Press, Inc.
- House, J. D., Hall, b. N., & Brosnan, J. Tón. (2001). Metabolizmus treonínu u izolovaných hepatocytov potkanov. American Journal of Physiology - Endokrinology a Metabolizmus, 281, 1300-1307.
- Hudson, b. (1992). Biochémia potravinových bielkovín. Springer-Science+Business Media, B.Vložka.
- Kaplan, m., & Flavin, m. (1965). Biosyntéza treok. Na ceste v hubách a baktériách a mechanizmus izomerizačnej reakcie. The Journal of Biological Chemistry, 240(10), 3928-3933.
- Kidd, m., & Kerr, B. (Devätnásť deväťdesiat šiestich). L-treok pre hydinu: recenzia. Applied Hydry Science, Inc., 358-367.
- Pratt, e., Snyderman, s., Cheung, m., Norton, P., & Holt a. (1954). Požiadavka treonínu normálneho dieťaťa. The Journal of Nutrition, 10(56), 231-251.
- Rigo, J., & Senterre, J. (1980). Optimálny príjem treonínu pre predčasne oslovenie kŕmených orálnou alebo parenterálnou výživou. Journal of Parenteral and Enteral Nutrition, 4(1), 15-17.
- Shyh-Chang, n., Lokasale, j. W., Lysssiotis, C. Do., Zheng a., Teo, r. A., Ratanasirintrawoot, s.,... Cantley, L. C. (2013). Vplyv metabolizmu treonínu na s-adenensylmetionín a metyláciu histónu. Veda, 339, 222-226.
- Vickery, h. B., & Schmidt, C. L. Do. (1931). História objavu aminokyselín. Chemické recenzie, 9(2), 169-318.
- MD Web. (n.d.). Získané 10. septembra 2019, od www.Webmd.com/vitamíny/ai/ingredientMo-1083/treonín
- Wormser, e. H., & Pardee,. B. (1958). Regulácia biosyntézy treonínu v Escherichia coli. Archívy biochémie a biofyziky, 78(2), 416-432.
- Xunyan, x., Quinn, P., & Xiaoyuan, x. (2012). Výskumná brána. Získané 10. septembra 2019, od www.Výskumy.net/figur/the-biosyntéza-pathway-of-L---------paly-patway-consists-fi-eny-enzymatic-steps_fig1_232320671

