Čo je, diagram a cvičenie molekulárnej energie
- 4364
- 409
- MUDr. Miloslav Habšuda
Ten priepustnosť Optika je kvocient medzi vznikajúcou intenzitou svetla a intenzitou intenzity svetla na vzorke priesvitného roztoku, ktorý bol osvetlený monochromatickým svetlom.
Fyzický proces prechodu svetla cez vzorku sa nazýva svetelný prenos a priepustnosť Je to miera prenosu svetla. Transmitancia je dôležitá hodnota na stanovenie koncentrácie vzorky, ktorá sa všeobecne rozpustí v rozpúšťadle, ako je voda alebo alkohol,.
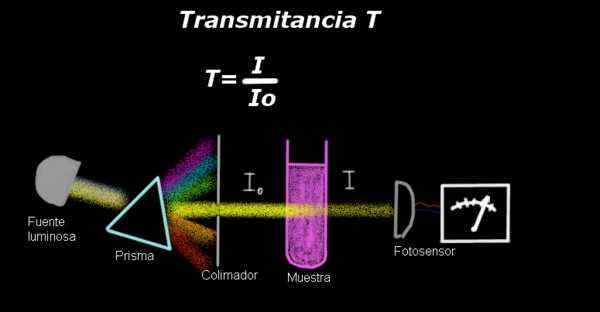
 postava 1. Zostava na meranie priepustnosti. Zdroj: f. Zapata.
postava 1. Zostava na meranie priepustnosti. Zdroj: f. Zapata. Elektrotometer meria prúd úmerný intenzite svetla, ktorý ovplyvňuje jeho povrch. Na výpočet priepustnosti sa všeobecne meria signál intenzity zodpovedajúceho samotnému rozpúšťadlu a tento výsledok sa zaznamenáva ako Io.
Potom vzorka rozpustená v rozpúšťadle s rovnakými podmienkami osvetlenia a nameraný signál elektro-fotometra je označený ako označený ako označený ako označený ako Jo, Potom sa priepustnosť vypočíta podľa nasledujúceho vzorca:
T = i / iani
Je potrebné poznamenať, že priepustnosť je bezrozmerné množstvo, pretože ide o mieru intenzity svetla vzorky vo vzťahu k intenzite prenosu rozpúšťadla.
[TOC]
Čo je priepustnosť?
Absorpcia svetla v médiu
Keď svetlo prechádza vzorkou, časti svetla je absorbovaná molekulami. Priepustnosť je makroskopická miera javu, ktorý sa vyskytuje na molekulárnej alebo atómovej úrovni.
Svetlo je elektromagnetická vlna, energia, ktorú prepravuje, je v elektrickom a magnetickom poli vlny. Tieto oscilujúce polia interagujú s molekulami látky.
Môže vám slúžiť: Rutherford Atomic Model: História, experimenty, postulátyEnergia, ktorá prepravuje vlnu, závisí od jej frekvencie. Monochromatické svetlo má iba jednu frekvenciu, zatiaľ čo biele svetlo má frekvenčný rozsah alebo spektrum.
Všetky frekvencie elektromagnetickej vlny sa pohybujú vo vákuu rovnakou rýchlosťou 300 000 km/s. Ak označíme c Pri rýchlosti svetla vo vákuu vzťah medzi frekvenciou F a vlnová dĺžka λ je:
C = λ⋅f
Ako c Je to konštanta pri každej frekvencii zodpovedá jej príslušnej vlnovej dĺžke.
Na meranie priepustnosti látky sa používa oblasti viditeľného elektromagnetického spektra (380 nm pri 780 nm), ultrafialová oblasť (180 až 380 nm) a región infračerveného (780 nm až 5600 nm)
Rýchlosť šírenia svetla v materiálnom médiu závisí od frekvencie a je menšia ako c. To vysvetľuje disperziu v hranolu, s ktorým sa dajú oddeliť frekvencie, ktoré tvoria biele svetlo.
Molekulárna teória absorpcie svetla
Atómy a molekuly kvantifikovali hladinu energie. Pri izbovej teplote sú molekuly na ich najnižšej úrovni energie.
Fotón je kvantová častica spojená s elektromagnetickou vlnou. Foton Energy je tiež kvantifikovaná, to znamená frekvenčný fotón F Má energiu daná:
E = H⋅f
kde h Je to Planckova konštanta, ktorej hodnota je 6,62 × 10^-34 jleks.
Monochromatické svetlo je lúč fotónov frekvencie a danej energie.
Molekuly absorbujú fotóny, keď sa ich energia zhoduje s rozdielom potrebným na posunutie molekuly na vyššiu úroveň energie.
Prechody energie absorpciou fotónov v molekulách môžu byť niekoľkých typov:
Môže vám slúžiť: veveričkový klietkový motor1- Elektronické prechody, keď elektróny molekulárnych orbitálov prechádzajú na orbitál väčšej energie. Tieto prechody sa zvyčajne vyskytujú vo viditeľnom a ultrafialovom rozsahu a sú najdôležitejšie.
2- Vibračné prechody, kvantize sa kvantilizujú energie molekulárnej väzby a keď sa fotón infračervenej oblasti absorbuje, molekula prechádza do vyššieho vibračného energetického stavu.
3- Rotačné prechody, keď absorpcia fotónu vedie k molekule k rotačnému stavu väčšej energie.
Diagram molekulárnej energie
Tieto prechody sú lepšie pochopené pomocou diagramu molekulárnej energie znázornené na obrázku 2:
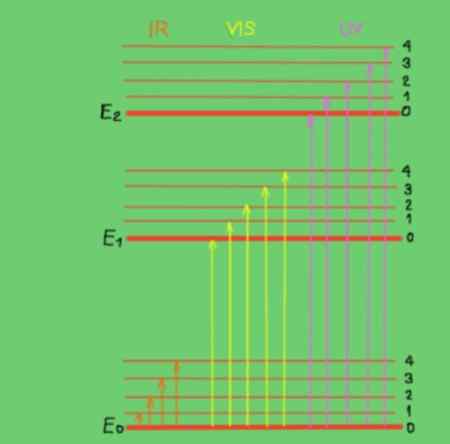 Obrázok 2. Diagram molekulárnej energie. Zdroj: f. Zapata.
Obrázok 2. Diagram molekulárnej energie. Zdroj: f. Zapata. V diagrame vodorovné línie predstavujú rôzne úrovne molekulárnej energie. Line E0 je základná alebo nižšia úroveň energie. Hladiny E1 a E2 sú nadšenými úrovňami vyššej energie. Úrovne E0, E1, E2 zodpovedajú elektronickým stavom molekuly.
Podsluhy 1, 2, 3, 4 v každej elektronickej úrovni zodpovedajú rôznym vibračným stavom zodpovedajúcim každej elektronickej úrovni. Každá z týchto úrovní má najkvalitnejšie pododdiely, ktoré nie sú preukázané, že zodpovedajú rotačným stavom spojeným s každou vibračnou úrovňou.
Schéma zobrazuje zvislé šípky, ktoré predstavujú energiu fotónov v infračervenom, viditeľnom a ultrafialovom rozsahu. Ako je vidieť, infračervené fotóny nemajú dostatok energie na podporu elektronických prechodov, namiesto toho viditeľné žiarenie a ultrafialové áno.
Keď sa dopadajúce fotóny monochromatického lúča zhodujú v energii (alebo frekvencii) s rozdielom v energii medzi stavom molekulárnej energie, potom nastane absorpcia fotónov.
Môže vám slúžiť: teplometrické stupniceFaktory v závislosti od priepustnosti
Podľa toho, čo bolo povedané v predchádzajúcej časti, bude priepustnosť závisieť od niekoľkých faktorov, z ktorých môžeme pomenovať:
1- Frekvencia, s ktorou sa vzorka rozsvieti.
2- typ molekúl, ktoré chcete analyzovať.
3- Koncentrácia roztoku.
4- Dĺžka cesty prešla svetlom lúča.
Experimentálne údaje naznačujú, že priepustnosť Tón s koncentráciou exponenciálne znižuje C A s dĺžkou Lokalita optickej cesty:
T = 10-A⋅c⋅l
V predchádzajúcom výraze do Je to konštanta, ktorá závisí od frekvencie a typu látky.
Cvičenie
Cvičenie 1
Vzorka vzoru určitej látky má koncentráciu 150 mikromolov na liter (μM). Keď sa meria vaša priepustnosť s 525 nm, získa sa priepustnosť 0 0.4.
Ďalšia vzorka tej istej látky, ale neznámeho koncentrácie má 0 prenosu.5, keď sa merali pri rovnakej frekvencii a s rovnakou optickou hrúbkou.
Vypočítajte koncentráciu druhej vzorky.
Odpoveď
Priepustnosť T sa rozpadá exponenciálne s koncentráciou C:
T = 10-Blekl
Ak vezmete logaritmus predchádzajúcej rovnosti, zostáva, zostáva:
log t = -b⋅c
Rozdelenie člena na člena Predchádzajúca rovnosť použitá na každú vzorku a vyčistenie neznámeho koncentrácie zostáva:
C2 = C1⋅ (log t2 / log t1)
C2 = 150 μm⋅ (log 0.5 / log 0.4) = 150 μm⋅ (-0.3010 / -0.3979) = 113.5 μm
Odkazy
- Atkins, str. 1999. Fyzikálna chémia. Vydanie omega. 460-462.
- Sprievodca. Prenos a absorbancia. Získané z: chémie.LAGUIA2000.com
- Environmentálna toxikológia. Priepustnosť, absorbancia a zákon Lamberta. Získané z: úložiska.Inovácia.je
- Dobrodružná fyzika. Absorpcia a priepustnosť. Získané z: rpfisica.Blog.com
- Sistofotometria. Získané z: Chem.Librettexts.orgán
- Environmentálna toxikológia. Priepustnosť, absorbancia a zákon Lamberta. Získané z: úložiska.Inovácia.je
- Wikipedia. Priepustnosť. Získané z: Wikipedia.com
- Wikipedia. Spektrofotometria. Získané z: Wikipedia.com

