Döbereiner triády
- 4244
- 224
- Gabriel Bahna
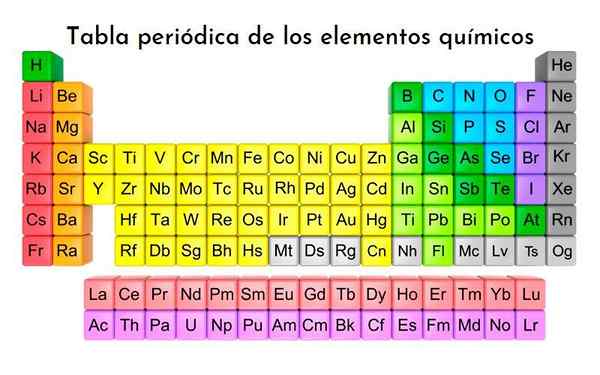
 Periodická tabuľka prvkov, všetky doteraz objavené chemické prvky sú klasifikované. S licenciou
Periodická tabuľka prvkov, všetky doteraz objavené chemické prvky sú klasifikované. S licenciou Čo sú to Döbereinerove triády?
Ten Döbereiner triády Sú prvým experimentom, v ktorom boli zoskupené tri chemické prvky, ktoré zdieľajú podobné charakteristiky a spájajú ich s ich atómovými váhami. Sú súčasťou 118 chemických prvkov, čo je rozmanitosť uvedených reakcií a ich zlúčeniny ich najvýznamnejší vzhľad.
Myšlienka klasifikácie prvkov je správne vysporiadať sa s ich chemickými vlastnosťami bez toho, aby vyvinula súbor pravidiel a teórií pre každú z nich.
Jeho periodická klasifikácia poskytla nesmierne užitočný systematický rámec na ich koreláciu podľa niekoľkých veľmi jednoduchých a logických vzorov.
Prvky sú systematicky usporiadané do riadkov a stĺpcov so zvyšujúcimi sa atómovými číslami a priestor pre nové objavy bol vyhradený.
V roku 1815 bolo známych iba okolo 30 prvkov. Aj keď o nich a ich zlúčeninách bolo k dispozícii veľa informácií, nebola zjavná objednávka.
Uskutočnilo sa niekoľko pokusov o nájdenie objednávky, bolo to však ťažké.
Objavte Döbereinerove triády
Vedec Johann Wolfgang Döbereiner (1780-1849) urobil dôležité zistenia o numerickej pravidelnosti medzi atómovými váhami prvkov. Bol prvým, kto si všimol existenciu niekoľkých skupín troch prvkov, ktoré nazval Triads, čo vykazovalo chemické podobnosti.
Tieto prvky odhalili dôležitý numerický vzťah, pretože po objednaní podľa ich ekvivalentu alebo atómovej hmotnosti sa hmotnosť centrálneho prvku ukázala ako približný priemer týchto dvoch zostávajúcich prvkov v trojici.
Môže vám slúžiť: fosforečnan sodný: štruktúra, vlastnosti, syntéza, použitieV roku 1817 Döbereiner zistil, že ak sa určité prvky kombinovali s kyslíkom v binárnych zlúčeninách, mohol sa medzi ekvivalentnými váhami týchto zlúčenín rozoznať numerický vzťah medzi ekvivalentnými váhami týchto zlúčenín.
Keď sa teda uvažovalo o oxidoch vápnika, stroncia a oxidov bárnat. Hovorí sa, že tieto tri príslušné prvky, stroncium, vápnik a bária, tvoria trojicu.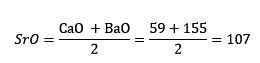
Aj keď Döbereiner pracoval s pesos, ktorý bol odvodený z malých prísnych experimentálnych metód, ale v platnosti na tento čas, ich hodnoty sú úzko dobré.
Döbereinerove pozorovanie malo malý vplyv na chemický svet, ale potom sa stal veľmi vplyvným. V súčasnosti sa považuje za jedného z priekopníkov vývoja periodického systému.
O dvanásť rokov neskôr, v roku 1829, Döbereiner pridal tri nové triády, ktoré sú uvedené nižšie:
Halogénová skupina
Chlór, bróm a jód majú podobné chemické vlastnosti a tvoria trojicu. Tieto prvky sú veľmi reaktívne kovy. Ak sú uvedené v poradí zvyšujúcej sa relatívnej hmoty, sú rádovo znížené reaktivita. Bromo má strednú atómovú hmotu medzi chlórom a jódom.

Atómová hmotnosť priemernej brómu.
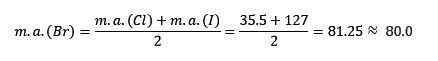
Priemerná získaná hodnota je blízko atómovej hmotnosti brómu (BR).
Podobnosti v chemických vlastnostiach:
1. Všetky sú to ne -metal.
2. Všetky reagujú s vodou za vzniku kyselín (napríklad v: HCI, HBR, HF).
Môže vám slúžiť: bionafta: história, vlastnosti, typy, výhody, nevýhody3. Každý má valenciu jedného (napríklad v: HCI, HBR, HF).
4. Všetky reagujú s alkalickými kovmi za vzniku neutrálnych solí (napríklad NaCl, NaBAB, NAI)
Alkalická skupina
Lítium, sodík a draslík majú podobné chemické vlastnosti a tvoria trojicu. Tieto prvky sú mäkké a ľahké, ale veľmi reaktívne kovy.
Ak sú uvedené v poradí zvyšujúcej sa relatívnej atómovej hmotnosti, sú tiež v poradí zvýšenej reaktivity. Sodík má strednú atómovú hmotu medzi lítiom a draslíkom.

Atómová hmotnosť sodného centrálneho prvku (NA) sa rovná priemeru atómovej hmoty lítium (LI) a draslíka (k).
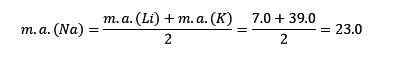
Podobnosti v chemických vlastnostiach:
1. Všetky sú kovy.
2. Všetci reagujú s vodou za vzniku alkalických roztokov a plynného vodíka.
3. Každý má Valencia de One (napríklad v: LICL, NACL, KCL).
4. Jeho uhličitany sú odolné voči tepelnému rozkladu.
Skupina kalkogénov alebo amfumí
Síra, selén a teluro majú podobné chemické vlastnosti a tvoria trojicu. Selén má strednú atómovú hmotu medzi síry a teluro.

Atómová hmotnosť priemerného prvku selénu (SE) sa rovná priemernej atómovej hmotnosti síry (S) a teluro (TE).
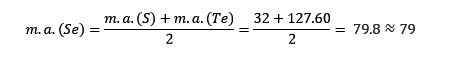
Priemerná získaná hodnota je opäť blízko k atómovému cesta selénu (SE).
Podobnosti v chemických vlastnostiach:
1. Kombinácie s hydrogénmi týchto prvkov vedú k toxickým plynom.
2. Každý z týchto prvkov má 6 valenčných elektrónov.
3. Kovové vlastnosti sa zvyšujú so zvyšujúcim sa atómovým počtom.
Döbereiner tiež varoval, že aby som bol platný, triády museli odhaliť chemické vzťahy medzi prvkami, ako aj numerické vzťahy.
Môže vám slúžiť: chlorečník draselného (KCLO3)Na druhej strane odmietol zoskupovať fluorid spolu s chlórom, brómom.
Tiež sa zdráhal uvažovať o výskyte trojíc medzi odlišnými prvkami, ako je dusík, uhlík a kyslík, hoci vykazovali významný triadický numerický vzťah.
Döbereinerova práca sa zameriavala na vzťahy medzi prvkami trojice, ale nedala potuchy o vzťahu medzi nimi.
Stačí povedať, že vyšetrovanie Döbereinera stanovilo pojem triád ako silného konceptu, že niekoľko ďalších chemikálií by čoskoro vzalo do úvahy.
Döbereiner triády v skutočnosti predstavovali prvý krok k zoskupeniu prvkov do vertikálnych stĺpcov v periodickej tabuľke, a tak vytvoril systém, ktorý vysvetľuje chemické vlastnosti a odhaľuje fyzické vzťahy prvkov.
Rozširovanie trojíc
Iné chemikálie rozšírené Döbereinerove triády tak, aby zahŕňali viac ako pôvodné tri prvky. Napríklad fluorid sa pridal do vrchu triády obsahujúcej chlór, bróm a jód.
Vyskytli sa ďalšie „triády“, ako napríklad ten, ktorý obsahoval kyslík, síru, selén a telurio. Ale nebol žiadny systém na ich koreláciu ako celok.
Jednou z hlavných nepríjemností bolo to, že veľa relatívnych atómových hmôt sa stále mýlilo.
Odkazy
- Johann Wolfgang Döbereiner. Zotavené z Britannice.com.
- Čo je skupina 16 z pravidelnej tabuľky? Ako sa používajú tieto prvky? Zotavené z Quory.com.

