Ziehl-Neelsen Farbining
- 973
- 155
- MUDr. Miloslav Habšuda
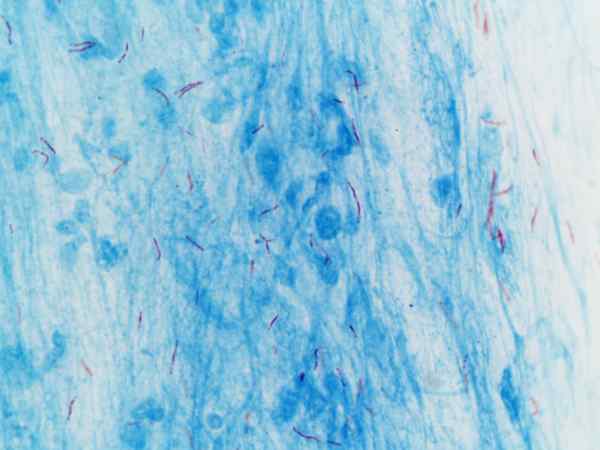
 Mycobacterium tuberculosis vizualizovaná s farbením Ziehl-Neelsen
Mycobacterium tuberculosis vizualizovaná s farbením Ziehl-Neelsen Čo je farbenie Ziehl-Neelsen?
Ten Ziehl-Neelsen Farbining V technike sfarbenia na identifikáciu rezistentných mikroorganizmov kyseliny alkoholu (AAR). Názov tohto mikrobiologického postupu sa týka jeho autorov: bakteriológ Franz Ziehl a patológ Friedrich Neelsen.
Táto technika je typ rozdielu farieb, ktorý naznačuje použitie rôznych farbív na vytvorenie kontrastu medzi štruktúrami, ktoré sú potrebné na pozorovanie, rozlíšenie a následne identifikovať. Farbenie Ziehl-Neelsena slúži na identifikáciu určitých typov mikroorganizmov.
Niektoré z týchto mikroorganizmov sú mykobaktérie (napríklad, Tuberkulóza mycobacterium), Nokardia (napríklad, Nokardia spona.) a niektoré jednobunkové parazity (napríklad, Kryptosporidium parvum). Mnohé z baktérií možno klasifikovať prostredníctvom spoločnej techniky nazývanej gram farbenie.
Niektoré bakteriálne skupiny však vyžadujú ďalšie metódy na ich identifikáciu. Techniky, ako je farbenie Ziehl-Neelsen.
Potom prichádza proces sfarbenia, ktorý umožňuje získať dva výsledky: rezistencia alebo citlivosť na sfarbenie kyselín a alkoholov.
Základ
Základ tejto techniky farbenia je založený na vlastnostiach bunkovej steny týchto mikroorganizmov. Stena je tvorená typom mastných kyselín nazývaných mykolové kyseliny; Tieto sa vyznačujú prezentáciou veľmi dlhých reťazcov.
Ak majú mastné kyseliny veľmi dlhé štruktúry, môžu tieto farbivá ľahšie udržať. Niektoré žánre baktérií je veľmi ťažké farbiť gramovým farbením v dôsledku vysokého obsahu kyselín mykolových kyselín z bunkovej steny.
Pri farbení Ziehl-Neelsen sa používa fenolová fenolová zlúčenina fuchsínu, základné farbivo. To má schopnosť interagovať s mastnými kyselinami bunkovej steny, ktorá má textúru cerosa pri teplote miestnosti.
Môže vám slúžiť: monosacharidyFarbenie fuchsínovým karbolom sa zlepšuje v prítomnosti tepla, pretože vosk sa topí a sfarbenie molekúl sa pohybujú rýchlejšie do bunkovej steny.
Kyselina použitá neskôr slúži na sfarbenie buniek, ktoré neboli zafarbené, pretože ich stena nesúvisí s farbivom; Preto sila kyseliny kyslej kyseliny je schopná eliminovať kyslé farbivo. Bunky, ktoré odolávajú tomuto sfarbeniu, sa nazývajú rezistentné na kyselinu.
Sekundárne farbivo
Po sfarbení vzorky sa to kontrastuje s ďalším farbivom nazývaným sekundárne farbivo. Mustileo Blue alebo Malachit Green sa všeobecne používa.
Sekundárne farbivo zafarbí materiál na pozadie a následne vytvára kontrast so štruktúrami, ktoré boli zafarbené v prvom kroku. Iba sfarbené bunky absorbujú druhé farbivo (protiútok) a berú svoju farbu, zatiaľ čo bunky odolné voči kyselinám udržiavajú červenú farbu.
Tento postup sa často používa na identifikáciu Tuberkulóza mycobacterium a Mycobacterium, ktoré sa nazývajú rezistentné bacily alkoholu kyseliny.
Činidlá
Primárne farbivo
Používa sa 0,3 % fuchsin carbol (filtrované). Toto farbivo sa pripravuje zo zmesi alkoholov: fenol etanolu (90 %) alebo metanol (95 %) av tejto zmesi 3 gramy základného fuchsínu sa rozpustia.
Diskingový roztok
V tomto kroku môžete použiť roztoky 3 % kyseliny alkoholu alebo 25 % kyseliny sírovej.
Sekundárne sfarbenie (protiklady)
Najpoužívanejšie farbivo na kontrast vo vzorkách je obvykle 0,3 % metylénovej modrej. Môžu sa však použiť aj iní, napríklad 0,5 % Malachit Green.
Môže vám slúžiť: TiminaTechnika
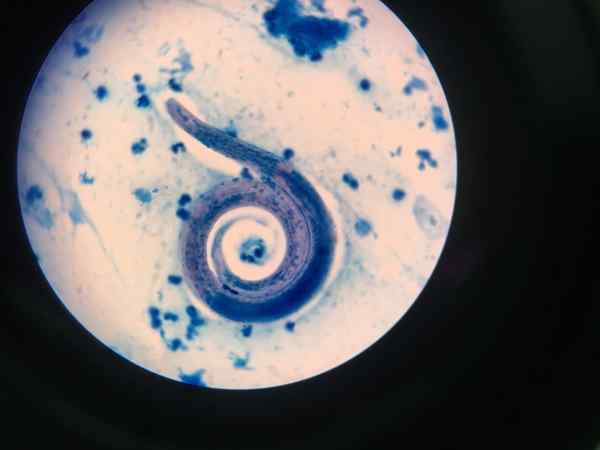 Nematódy zobrazené so Ziehl-neelsen
Nematódy zobrazené so Ziehl-neelsen Postup zafarbenia kyslého uplatnený
Pripravte bakteriálnu náter
Tento prípravok sa vykonáva na čistom a suchom posúvaní po preventívnych preventívnych opatreniach sterility.
Sušenie frovis
Nechajte rozmazanie uschnúť pri izbovej teplote.
Zohriať vzorku
Vzorka sa musí zahrievať použitím ohňa na sklíčko pod. Fixácia s alkoholom sa môže urobiť, keď sa vôňa nepripravuje so spútam (ošetrená chlórnanom sodným na jeho bielenie) a ak sa nebude okamžite zafarbiť.
M. tuberkulóza je eliminovaný bielidlom a počas procesu farbenia. Termofixácia neotreného spúta nezabije M. tuberkulóza, Zatiaľ čo fixácia alkoholu je baktericíd.
Zakryť škvrnu
Farba je pokrytá roztokom karbol Fuchsin (primárne základné sfarbenie).
Zohriať škvrnu
Toto sa robí 5 minút. Mali by ste si všimnúť oddelenie pary (približne 60 ° C). Je dôležité, aby ste sa neprehrievali a vyhýbali sa spáleniu vzorky.
Pokiaľ ide o zahrievanie škvrny, mali by ste byť veľmi opatrní pri zahrievaní fuchsínového karbolu, najmä ak sa zafarbenie vykonáva na podnose alebo inej nádobe, v ktorej sa z predchádzajúceho predchádzajúceho farbenia zbierali vysoko horľavé chemikálie.
Pod sklíčkami by sa mal aplikovať iba malý plameň pomocou tampónu, ktorý sa predtým navlhčil niekoľkými kvapkami kyslého alkoholu, metanolu alebo 70 % etanolu. Vyhnite sa použitiu veľkého tampónu namočeného v etanolu, pretože je to riziko požiaru.
Umyť škvrnu
Toto umývanie sa musí vykonávať čistou vodou. Ak voda z vodovodu nie je čistá, umyte si trenie filtrovanou alebo destilovanou vodou, najlepšie.
Zakryte náter kyslým alkoholom
Tento kyslý alkohol musí byť na 3 %. Pokrytie sa vykonáva 5 minút alebo dovtedy, kým nie je zápach dostatočne sfarbený, to znamená bledo ružové.
Môže vám slúžiť: epiblastJe potrebné vziať do úvahy, že kyslý alkohol je horľavý; Preto by sa mal používať veľmi opatrne. Vyvarujte sa blízko zdrojom zapaľovania.
Umyť škvrnu
Umývanie by malo byť s čistou, destilovanou vodou.
Zakryte náter farbivom
Môže to byť malachitovo zelené sfarbenie (0,5 %) alebo metylénová modrá (0,3 %) počas 1 alebo 2 minút, pričom je to hlasnejší čas, ak je zápach tenký.
Umyť škvrnu
Čistá voda (destilovaná) by sa mala znova použiť.
Odhodiť
Zadná časť posúvača musí byť vyčistená a škvrna sa umiestni na drenážnu poličku, aby vyschla do vzduchu (na sušenie nepoužíva absorpčný papier).
Preskúmajte náter v mikroskope
Mal by sa použiť cieľ 100x a ponorného oleja. Systematicky naskenujte náter a zapíšte príslušné pozorovania.
Interpretovať výsledky
Teoreticky sa mikroorganizmy, ktoré sú farbené z červenkastej farby.
Naopak, ak sú mikroorganizmy zafarbené modré alebo zelené, v závislosti od farbiva používaného ako protiútok, sú považované za negatívnu rezistentnú kyselinu (AAR-).
Odkazy
- Apurba, s. & Sandhya, B. (2016). Základy praktickej mikrobiológie (1. vydanie.). Lekárski vydavatelia Jaypee Brothers.
- Bauman, r. (2014). Mikrobiológia s Deseodas podľa systému Body (4. ED.). Pearson Education, Inc.
- Dedičstvo, J., Evans, e. & Killington, a. (Devätnásť deväťdesiat šiestich). Úvodná mikrobiológia (1. vydanie.). Cambridge University Press.
- Morello, J., Granato, p. Wilson, m. & Morton, V. (2006). Laboratórna príručka a zošit v mikrobiológii: Aplikácie na starostlivosť o pacienta (11. vydanie.). McGraw-Hill Education.
- Vasanthakumari, r. (2007). Učebnica mikrobiológie (1. vydanie.). B.Jo. Publikácie Pvt.

