Termochémia

- 4228
- 115
- MUDr. Miloslav Habšuda
Vysvetľujeme, že je to termochémia, aké štúdie, jej zákony a aplikácie
 V termochémii sa tepelné modifikácie študujú v chemických reakciách
V termochémii sa tepelné modifikácie študujú v chemických reakciách Čo je termochémia?
Ten Termochémia Je zodpovedný za štúdium tepelných modifikácií, ktoré sa vykonávajú pri reakciách medzi dvoma alebo viacerými chemickými druhmi. Považuje sa za nevyhnutnú súčasť termodynamiky, ktorá študuje transformáciu tepla a iných typov energie, aby pochopila smer, ktorým sa procesy vyvíjajú a ako sa jeho energia mení.
Je tiež nevyhnutné pochopiť, že teplo zahŕňa prenos tepelnej energie, ktorá sa vyskytuje medzi dvoma telami, keď sú pri rôznych teplotách; Zatiaľ čo tepelná energia je spojená s náhodným pohybom, ktorý majú atómy a molekuly.
Preto, ako takmer všetky chemické reakcie, energia sa absorbuje alebo uvoľňuje tepelne, analýza javov, ktoré sa vyskytujú prostredníctvom termochémie, je veľmi relevantná.
Aké štúdie termochémia?
Termochémia študuje zmeny tepla vo forme tepla, ktoré sa vyskytujú pri chemických reakciách alebo keď sa vyskytujú procesy, ktoré naznačujú fyzikálne transformácie.
V tomto zmysle musia byť určité pojmy objasnené v rámci subjektu, aby sa to isté porozumelo.
Systém
Napríklad pojem „systém“ sa týka konkrétneho segmentu vesmíru, ktorý sa študuje, ktorý sa chápe ako „vesmír“, zváženie systému a jeho okolia (všetko vonkajšie).
Systém teda všeobecne pozostáva z druhov zapojených do chemických alebo fyzikálnych transformácií, ktoré sa vyskytujú pri reakciách. Tieto systémy možno rozdeliť do troch typov: otvorené, uzavreté a izolované:
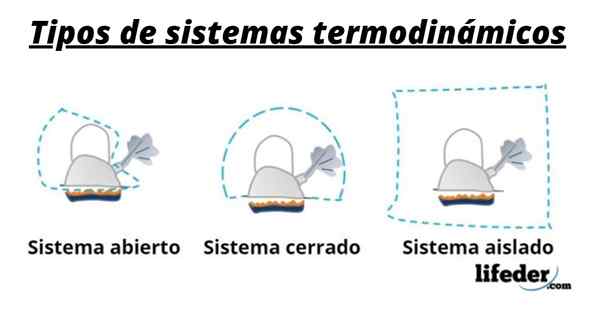
- Otvorený systém je systém, ktorý umožňuje prenos hmoty a energie (teplo) so svojím okolím.
- V uzavretom systéme je výmena energie, ale nie hmota.
- V izolovanom systéme nie je uvedený prenos hmoty alebo energie vo forme tepla. Tieto systémy sú známe aj ako „adiabatické“.
Termochemické zákony
 Germain Hess, tvorca Hessovho zákona, základný pre termochémiu
Germain Hess, tvorca Hessovho zákona, základný pre termochémiu Zákony termočemie sú úzko spojené s Laplaceom a Lavoisierovým zákonom, ako aj s Hessovým zákonom, ktoré sú predchodcami prvého zákona o termodynamike.
Princíp stanovený francúzskym antoine Lavoisier (dôležitý chemický a ušľachtilý) a Pierre-Simon Laplace (slávny matematik, fyzikálny a astronóm) preskúmajú, že „zmena v energii, ktorá sa prejavuje v akejkoľvek fyzikálnej alebo chemickej transformácii Rozsah v rozpore so zmenou energie spätnej reakcie “.
Zákon
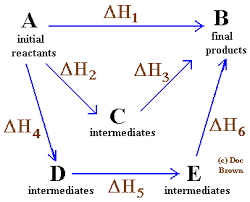
 Jednoduchý a všeobecný diagram, v ktorom sa uplatňuje zákon HESS pre štyri chemické reakcie
Jednoduchý a všeobecný diagram, v ktorom sa uplatňuje zákon HESS pre štyri chemické reakcie V rovnakom poradí nápadov je zákon formulovaný ruským chemikom zo Švajčiarska Germain Hess, základným kameňom pre vysvetlenie termochémie.
Tento princíp je založený na jej výkladu zákona o ochrane energie, ktorý sa týka skutočnosti, že energiu nie je možné vytvoriť alebo zničiť, iba transformovaná, iba transformovaná.
Hessov zákon sa dá vyhlasovať týmto spôsobom: „Celková entalpia v chemickej reakcii je rovnaká, či sa reakcia vykonáva v jednom kroku, akoby k nemu došlo v poradí niekoľkých krokov“.
Celková entalpia sa vyskytuje ako odčítanie súčtu entalpie výrobkov s výnimkou súčtu entalpie reaktantov.
V prípade zmeny štandardnej entalpie systému (v štandardných podmienkach 25 ° C a 1 atm) sa môže schematizovať podľa nasledujúcej reakcie:
Môže vám slúžiť: kyselina chlorogenováΔHreakcia = ΣδH(Produkty) - ΣδH(reaktanty)
Ďalším spôsobom, ako vysvetliť tento princíp, s vedomím, že zmena entalpie sa vzťahuje na zmenu tepla v reakciách, keď sa vyvíjajú na konštantný tlak, hovorí, že zmena v sieti entalpia systému nezávisí od cesty, že cesta, že cesta, ktorá nasleduje medzi pôvodným stavom a koncom.
Prvý zákon termodynamiky
Tento zákon je tak vnútorne spojený s termochémiou, že je niekedy zmätený, ktorý z nich inšpiroval druhého; Aby sme dali svetlá na tomto zákone, musíme začať tým, že má tiež svoje korene v princípe ochrany energie.
Takže termodynamika berie do úvahy iba teplo ako formu prenosu energie (napríklad termochémia), ale zahŕňa aj iné formy energie, ako napríklad vnútorná energia (Alebo).
Variácia vnútornej energie systému (AU) je teda daná rozdielom medzi jeho počiatočnými a konečnými stavmi (ako je vidieť v zákone HESS).
Berúc do úvahy, že vnútorná energia sa skladá z kinetickej energie (pohyb častíc) a potenciálnej energie (interakcie medzi časticami) toho istého systému, je možné odvodiť, že existujú aj ďalšie faktory, ktoré prispievajú k štúdiu štátu a vlastností každého systému.
Termochémia
Termochémia má viac aplikácií, niektoré z nich budú uvedené nižšie:
- Stanovenie energetických zmien v určitých reakciách pomocou kalorimetrie (meranie tepelných zmien v určitých izolovaných systémoch).
- Odpočet zmien entalpie v systéme, aj keď ich priamym meraním nemôžu byť známe.
- Analýza tepelných transferov produkovaných experimentálne, keď sa vytvárajú organometalické zlúčeniny s prechodnými kovmi.
- Štúdium transformácií energie (v teple) podávané v zlúčeninách koordinácie polyamínov s kovmi.
- Stanovenie entalpií kov-oxygénovej väzby β-DIC a β-DIC spojené s kovmi.
- Rovnako ako v predchádzajúcich aplikáciách, termochémia sa môže použiť na určenie veľkého počtu parametrov spojených s inými typmi energetických alebo štátnych funkcií, ktoré sú tie, ktoré definujú stav systému v danom čase.
- Termochémia sa používa aj pri štúdiu mnohých zložených vlastností, ako v titračnej kalorimetrii.
Odkazy
- Wikipedia. (s.F.). Termochémia. Získaný z.Wikipedia.orgán
- Chang, R. (2007). Chémia, deviate vydanie. Mexiko: McGraw-Hill.
- Librettexts. (s.F.). Termochémia - recenzia. Získané od Chem.Librettexts.orgán
- Tyagi, P. (2006). Termochémia. Zotavené z kníh.Riadenie.co.ísť
- Ribeiro, m. Do. (2012). Termochémia a jej aplikácie na chemické a biochemické systémy. Získané z kníh.Riadenie.co.ísť
- Singh, n. B., Das, s. Siež., A Singh,. Klimatizovať. (2009). Fyzikálna chémia, zväzok 2. Zotavené z kníh.Riadenie.co.ísť

