Etyláter
- 1121
- 317
- Blažej Hrmo
 Etyléter je prchavá a horľavá tekutina, ktorá slúžila ako anestetikum v devätnástom storočí
Etyléter je prchavá a horľavá tekutina, ktorá slúžila ako anestetikum v devätnástom storočí Čo je etyléter?
On etyláter, Tiež známa ako dityl éter, je to organická zlúčenina, ktorej chemický vzorec je C4H10Ani. Vyznačuje sa tým, že je bezfarebnou a prchavou tekutinou, a preto sa jej fľaše musia udržiavať čo najskoršie uzavreté.
Tento éter. To znamená, že majú receptúru ROR ', kde R a R' predstavujú rôzne segmenty sýtené sýtené. A ako je opísané podľa jeho druhého mena, dityl éter, sú dva radikály - -etyl, ktoré sú spojené s atómom kyslíka.
Na začiatku bol etyléter použitý ako všeobecný anestetik, ktorý v roku 1846 predstavil William Thomas Green Morton. Avšak kvôli jeho horľavosti bolo jeho použitie vyradené a nahradilo ho iným menej nebezpečnými anestetikami.
Táto zlúčenina sa tiež používa na výpočet času krvného obehu, počas vyhodnotenia kardiovaskulárneho stavu pacienta.
Etyléter
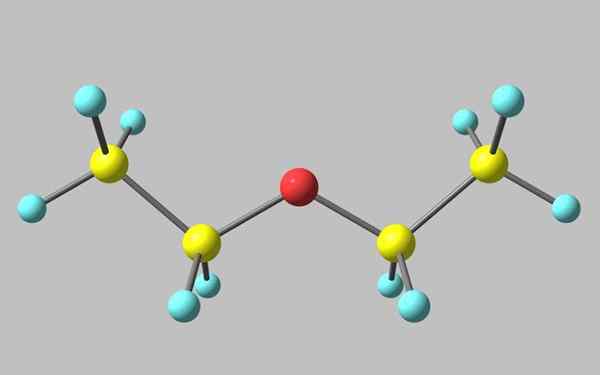 Chemická štruktúra etyléteru
Chemická štruktúra etyléteru Na vynikajúcom obraze je znázornenie s modelom guľôčok a tyčí molekulárnej štruktúry etyléteru.
Ako je zrejmé, červená guľa, zodpovedajúca atómu kyslíka, má dve etylové skupiny spojené s oboma stranami. Všetky odkazy sú jednoduché, flexibilné a voľné rotácie okolo osí σ.
Tieto rotácie pochádzajú z stereoizomérov známych ako konformátory, ktoré viac ako izoméry sú alternatívnymi priestorovými stavmi. Štruktúra obrazu zodpovedá presne anti -konformátora, v ktorom sú všetky jeho skupiny atómov rozložené (od seba navzájom oddelené).
Druhý konfruero je zatienený, a hoci to nie je dostupný obraz, stačí ho vizualizovať pomocou u -tvare. Na horných koncoch u sa nachádza metylové skupiny, -ch3, čo by zažilo stérické odpory (zrazili by sa vo vesmíre).
Môže vám slúžiť: Faraday ConstantPreto sa dá očakávať, že Choova molekula3Chvály2Okradnúť2Chvály3 väčšinu času prijať proti formácii.
Fyzikálne a chemické vlastnosti etyláter
Ostatné mená
- Dietyléter
- Etoxytano
- Etylxid
Molekulárna receptúra
C4H10O o (c2H5)2Ani.
Molekulová hmotnosť
74.14 g/mol.
Fyzický vzhľad
Bezfarebná tekutina.
Vôňa
Sladké a pikantné.
Príchuť
Horieť.
Bod varu
94.3 ° F (34.6 ° C) pri 760 mm Hg.
Bod topenia
-177.3 ° F (-116.3 ° C). Stabilné kryštály.
zapaľovač
-49 ° F (uzavretý nádoba).
Rozpustnosť
6.04 g/100 ml pri 25 ° C.
Rozpustnosť v iných tekutinách
Misilné s alifatickým, benzénom, benzénom, chloroformom, olejovým éterom, tukovým rozpúšťadlom, mnohými olejmi a koncentrovanou kyselinou chlorovodíkovou.
Rozpustný v acetóne a veľmi rozpustný v etanole. Je tiež rozpustný v benzíne, benzéne a olejoch.
Hustota
0.714 mg/ml pri 68 ° F (20 ° C).
Hustota pary
2.55 (vo vzťahu k vzduchu odobraté s hustotou 1).
Tlak vodnej pary
442 mm Hg pri 68 ° F. 538 mm Hg pri 25 ° C. 58,6 kPa pri 20 ° C.
Stabilita
Pomaly sa oxiduje pôsobením vzduchu, vlhkosti a svetla s tvorbou peroxidov.
Tvorba peroxidov sa môže vyskytnúť v éterových nádobách, ktoré sú otvorené a zostávajú v skladovaní viac ako šesť mesiacov. Peroxidy môžu vyvolať trenie, náraz alebo zahrievanie.
Jeho kontakt s: zinkom, halogénom, nemetalickým oxidizačným činidlám, chromylchloridom, olejmi, dusičnanmi a kovovými chloridmi by sa mali vyhnúť.
Vlastné zapaľovanie
180 ° C).
Rozklad
Keď sa zahreje, rozpadá sa, vydáva aker a dráždi dym.
Hrebeň
0.2448 Poise pri 20 ° C.
Spaľovacie teplo
8.807 kcal/g.
Môže vám slúžiť: Einstenio (S): Štruktúra, vlastnosti, získavanie, použitie, použitiaOdparovanie
89.8 vápno/g a 30 ° C.
Povrchové napätie
17.06 dynam/cm pri 20 ° C.
Ionizačný potenciál
9.53 EV.
Prah
0.83 ppm (čistota nie je uvedená).
Index lomu
1.355 až 15 ° C.
Získanie etyláter
Etyléter z etylalkoholu je možné získať v prítomnosti kyseliny sírovej ako katalyzátora. Kyselina sírová vo vodnom médiu disociácie produkujúcich hydrónsky ión, H3Ani+.
V opačnom procese, to znamená, hydratácia etylénu v parnej fáze môže etyléter tvoriť okrem etylalkoholu ako kolaterálny produkt. V skutočnosti táto syntetická cesta vytvára väčšinu tejto organickej zlúčeniny.
Toxicita etyláter
Môže produkovať podráždenie pokožky a očí. Kontakt kože môže spôsobiť jeho resekciu a praskanie. Éter zvyčajne neprenikne do pokožky, pretože sa rýchlo odparí.
Podráždenie očí spôsobených éterom je zvyčajne mierne a v prípade závažného podráždenia je poškodenie všeobecne reverzibilné.
Jeho požitie vyvoláva narkotické účinky a podráždenie žalúdka. Ťažké požitie môže spôsobiť poškodenie obličiek.
Vdýchnutie éteru môže spôsobiť podráždenie nosa a krku. V prípade inhalácie éteru sa môže produkovať: ospalosť, vzrušenie, závraty, zvracanie, nepravidelné dýchanie a zvýšenie slinenia.
Vysoká expozícia môže spôsobiť stratu vedomostí a dokonca aj smrť.
OSHA stanovuje v priemere limit expozície práce 800 ppm, počas 8 -hodinovej zmeny.
Úrovne podráždenia očí: 100 ppm (ľudia). Úrovne podráždenia očí: 1200 mg/m3 (400 ppm).
Použitie/aplikácie etyláter
Organické rozpúšťadlo
Je to organické rozpúšťadlo, ktoré sa používa na rozpustenie brómu, jódu a iných halogénov. Väčšina lipidov (tukov), živice, čisté gumy, niektoré alkaloidy, gumy, parfumy, oct celulóza, dusičnan celulózy, uhľovodíky a farbivá.
Môže vám slúžiť: Žiadne kovy: História, vlastnosti, skupiny, použitieOkrem toho sa používa pri extrakcii aktívnych zložiek zvierat a rastlín, pretože má menšiu hustotu ako voda a pláva na ňom, takže požadované látky sa rozpustia v éteri.
Celková anestézia
Od roku 1840 sa používa ako všeobecný anestetikum a nahradí chloroformu za terapeutickú výhodu. Je to však horľavá látka, a preto nájdu vážne ťažkosti pri používaní v klinických oblastiach.
Okrem toho vyvoláva u pacientov niektoré nežiaduce pooperačné vedľajšie účinky, ako je nevoľnosť a zvracanie.
Z týchto dôvodov bolo použitie éteru vyradené ako všeobecný anestetik a nahradil ho inými anestetikami, ako je Halotano.
Éter
Éter zmiešaný etanol.
Hodnotenie krvného obehu
Éter sa použil na vyhodnotenie krvného obehu medzi jednou rukou a pľúcami. Éter sa vstrekuje do ramena, pričom krv berie doprava, potom do pravej komory a odtiaľ po pľúca.
Čas, ktorý uplynie od injekcie éteru, k zachyteniu zápachu éteru v vydýchnutom vzduchu, je približne 4 až 6 s.
Vyučovacie laboratóriá
Éter sa používa vo výučbových laboratóriách v mnohých experimentoch. Napríklad pri demonštrácii Mendelových zákonov genetiky.
Éter sa používa na znecitlivenie rodových múch Drosophila a umožniť potrebné kríže medzi nimi, zdôrazniť zákony genetiky.
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. Organická chémia. Amín. Wiley Plus.
- Éter. Zotavené z Britannice.com

