Molekulárna orbitálna teória

- 2929
- 337
- Adrián Fajnor
Čo je molekulárna orbitálna teória?
Ten Molekulárna orbitálna teória (Tom) Je to matematický model vyvinutý na vysvetlenie fyzikálno -chemických vlastností molekúl, ako je absorpcia a emisia žiarenia, elektrická vodivosť, ako aj elektronická povaha jej väzieb. Na rozdiel od teórie Link Valencia Link sa to zvažuje, že elektróny sa premiestnia v celej molekule, bez toho, aby boli pravdepodobné umiestnené v prepojeniach.
Preto molekulárna orbitálna teória uplatňuje rovnaké kvantové princípy, ktoré diktujú vlnové funkcie pre atómové orbitály, a tak opisujú energetický stav elektrónov v atómoch; Až teraz sa zameriava na tzv.
 Paramagnetizmus kvapalného kyslíka, a teda jeho príťažlivosť pre magnety, je vysvetlený vďaka molekulárnej orbitálnej teórii. Zdroj: Pieter Kuipeper cez Wikipedia.
Paramagnetizmus kvapalného kyslíka, a teda jeho príťažlivosť pre magnety, je vysvetlený vďaka molekulárnej orbitálnej teórii. Zdroj: Pieter Kuipeper cez Wikipedia. Teória molekulárnej orbitálnej teórie potom funguje a pracuje s molekulárnymi orbitálmi, ich elektronické a priestorové rozdelenie, ako aj diagramy ich príslušných energií, ktoré umožňujú pozorovanie energetických medzier, ktoré ich oddeľujú. Predovšetkým vysvetľuje paramagnetizmus určitých látok, ako je molekulárny kyslík v kvapalnom stave (pozri vyššie).
O2, Popísané v Lewisových štruktúrach a Valencia's Link Theory, má všetky svoje párové elektróny, takže teoreticky by to malo byť diamagnetické. V praxi sa však ukázalo, že je skutočne paramagnetický, to znamená, že chýba elektróny; konkrétne pár chýbajúcich elektrónov.
Z konštrukcie OM diagramu (molekulárne orbitály) pre O2, Homonukleárna diatomická molekula, je zrejmé, že v skutočnosti existujú dva vysoké energetické elektróny. Nielen to, ale otáčanie a poloha týchto elektrónov v OMS tiež vysvetľujú ďalšie elektronické stavy alebo2 (single).
Iné z najdôležitejších víťazstiev molekulárnej orbitálnej teórie je to, že pomáha predpovedať možnú existenciu diatomických molekúl, ako aj ich relatívnu stabilitu. Molekulárna orbitálna teória je teda v predikcii molekúl, ako je b2 a li2, Aj keď môžu detekovať iba vo fáze pary pri vysokých teplotách. Táto teória tiež odmieta existenciu hypotetických, ktoré mám2 alebo ne2.
Typy molekulárnych väzieb a orbitálov
Rovnako ako v teórii Link Valencia, v molekulárnej orbitálnej teórii sa uvažuje niekoľko typov spojení v závislosti od smeru prekrývania atómových orbitálov zúčastňujúcich sa na chemickej väzbe. Medzi najdôležitejšie a prítomné v molekulárnej povahe máme väzby Sigma a Pi.
Sigma
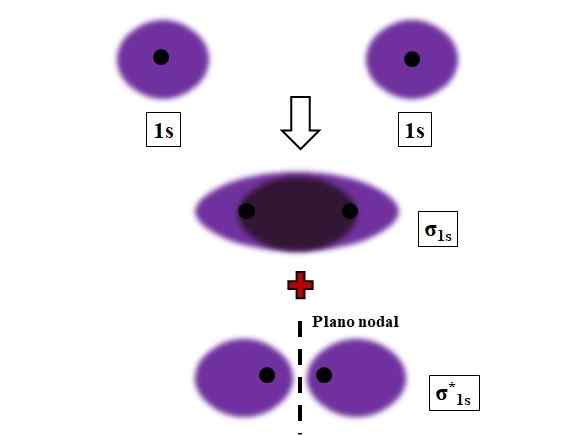 Tvorba odkazov σ1 a σ1s* počas prekrývania dvoch atómových orbitálov 1s. Zdroj: Gabriel Bolívar.
Tvorba odkazov σ1 a σ1s* počas prekrývania dvoch atómových orbitálov 1s. Zdroj: Gabriel Bolívar. Sigma, σ väzby sa stanovia, keď sa atómové orbitály prekrývajú predné, vo vzťahu k imaginárnej internukleárnej sekcii.
Zoberme si napríklad odkaz σ, ktorý sa tvorí, keď sú dve atómové orbitály podľa atómu vodíka blízko k veľmi krátkej vzdialenosti (obrázok vyššie). Pretože orbitály 1S sú symetrické, ich prekrývanie bude vždy čelné; Preto budú vždy generovať molekulárne orbitály σ1s a σ1s*.
Všimnite si teraz, keď molekulárny orbitálny σ1s zobrazuje elektronickú hustotu koncentrovanú v priestore, ktorý oddeľuje tieto dve jadrá. To znamená, že v orbitáli σ1s Pravdepodobnosť nájdenia elektrónu je v tejto oblasti molekuly maximálna. Elektróny σ1s Sú premiestnené do celého priestoru, ktorý pokrýva fialovú farbu.
Na druhej strane, v orbitáli σ1s* Máme uzlovú rovinu medzi týmito dvoma jadrami. To znamená, že pravdepodobnosť nájdenia elektrónu medzi týmto priestorom sa rovná nule. Všimnite si, že v orbitáli σ1s* Elektróny opisujú polohy okolo každého z týchto dvoch jadier; nie okolo molekuly ako celku.
Môže vám slúžiť: Rádio: Štruktúra, vlastnosti, použitie, získaniePI
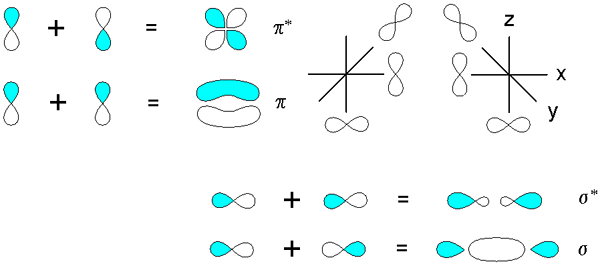 Sigma a Pi Bonds odvodené z prekrývania orbitálov P. Zdroj: v8rik na in.Wikipedia, CC BY-SA 3.0, cez Wikimedia Commons
Sigma a Pi Bonds odvodené z prekrývania orbitálov P. Zdroj: v8rik na in.Wikipedia, CC BY-SA 3.0, cez Wikimedia Commons Zvážte teraz molekulárne väzby a orbitály. K tomu dochádza, keď prekrývanie orbitálov nastane v smere kolmom na internucleárnu os, ktorá je svojvoľne fixovaná v ktorejkoľvek zo osí karteziánskej roviny. Za predpokladu, že hovoríme o orbitáli 2pX, Orbitál 2pa Bude zadarmo vytvoriť odkaz PI (pozri modré a biele laloky).
Keď dve orbitály 2pa Dva molekulárne orbitály vznikajú: π2py a π2py*; Prvý má najvyššiu elektronickú hustotu a pod internucleárnou osou, zatiaľ čo druhý pripomína štvorprúdový kvet, kde je pravdepodobnosť nájdenia elektrónov oveľa nižšia.
Na druhej strane, orbitály 2p, povedzme 2pX, Môžu sa tiež prekrývať na prednej strane, aby vznikli väzbu σ a dva molekulárne orbitály σ2px a σ2px*. Ako v prípadoch σ1s a σ1s*, Orbitál σ2px ukazuje väčšiu elektronickú hustotu medzi týmito dvoma jadrami; čo je v rozpore s σ2px*, kde sú elektróny orientované na strany vonkajšej strany.
Prepojiť
Linding Molecular Orbitals sú tie, ktoré prispievajú k stabilite molekuly. To znamená, že pred prepojením a vytvorením molekuly musia mať menej energie v porovnaní s atómovými orbitálmi jednotlivých atómov. V týchto orbitáloch sú elektróny premiestnené všetkými rozmermi molekuly ako celku.
V diagramoch OM budú vždy umiestnené pod atómovými orbitálmi, ktoré ich kombinujú, aby ich vytvorili. Toto bude podrobnejšie vidieť v nasledujúcich častiach.
Anti -hut
Na druhej strane sú molekulárne orbitály anti -housingu, ktoré destabilizujú molekulu. Sú symbolizovaní hviezdičkou (*) a ich energie sú vyššie ako energia atómových orbitálov, ktoré ich vznikli. Na týchto orbitáloch sa elektróny premiestnia dosť nepravidelne, akoby molekula bola elektronicky fragmentovaná.
V OM diagramoch budú vždy umiestnené nad atómovými orbitálmi, ktoré ich kombinujú, aby ich vytvorili.
Nie je prepojený
Medzitým sú net -libujúce orbitály, ako aj ich elektróny, ktoré neprispievajú alebo nepoškodzujú stabilitu molekuly. Jeho energie sú veľmi podobné energiám atómových orbitálov.
Príkaz na prepojenie
Poradie prepojenia sa stáva v teórii molekulárneho orbitálu, ako je číslo spojenia, je v teórii Link Valencia: Miera sily spojenia v molekule. Poradie odkazu teda rovnajúce sa 1 zodpovedá jednoduchému odkazu (-). A poradie odkazu (alebo.e) rovná 2, zodpovedá dvojitej väzbe (=). Tak.
Toto poradie sa určuje z počítania elektrónov v diagramoch OM pre konkrétnu molekulu. Na tento účel sa musí uplatniť nasledujúci vzorec:
ani.E = (počet prepojených elektrónov - počet anti -hut elektrónov)/2
Spojovacie elektróny prispievajú k molekule k stabilizácii, zatiaľ čo anti -ohodné elektróny ich destabilizujú. Preto čím viac anti -sung elektrónov, tým menšie alebo.E a molekula bude mať tendenciu byť veľmi nestabilná. Keď O.E sa rovná 0, znamená to, že molekula neexistuje (alebo aspoň teoreticky).
Om
V diagramoch OM sú zastúpené energie molekulárnych orbitálov a vizualizuje sa aj jej elektronická výplň, ktorá dodržiava pravidlá Aufbauf a Sinn, ako aj princíp vylúčenia Paulingu. Zoberme si napríklad nasledujúce dva diagramy:
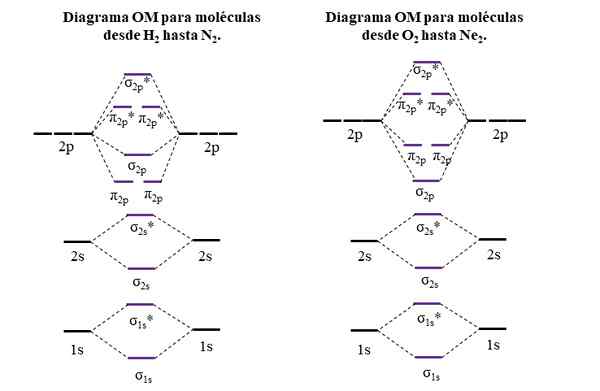 OM diagramy pre molekuly prvého a druhého obdobia periodickej tabuľky. Zdroj: Gabriel Bolívar.
OM diagramy pre molekuly prvého a druhého obdobia periodickej tabuľky. Zdroj: Gabriel Bolívar. Vodorovné čiary po stranách, čierne, predstavujú energie atómových orbitálov. Namiesto toho sú centrálne vodorovné čiary, fialové, energie molekulárnych orbitálov. Všimnite si, ako sú prepojenia a anti -agent OM distribuované (*) vo vzťahu k atómovým orbitálom jednotlivých atómov.
Môže vám slúžiť: aminoskupina (NH2): štruktúra, vlastnosti, príkladyVšimnite si tiež, že v pravom diagrame OM σ2 P Menia miesto s π2 P. K tomu dochádza s molekulami O2, F2, a hypotetický NE2.
Príklady
V nasledujúcich príkladoch bude OM pokračovať v elektronoch, vypočíta si poradie spojenia a predpovede o sile väzby alebo stability príslušnej molekuly.
H2
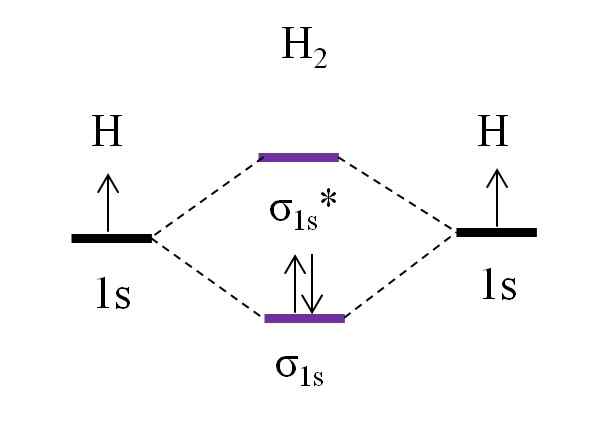 OM Diagram pre molekulu dihydrogénu. Zdroj: Gabriel Bolívar.
OM Diagram pre molekulu dihydrogénu. Zdroj: Gabriel Bolívar. Počnúc najjednoduchšou molekulou, dihydrogenom, h2, Dva atómy H sú spojené kombináciou svojich dvoch atómových orbitálov 1S za vzniku dvoch molekulárnych orbitálov σ1s a σ1s*. Tieto dva elektróny potom pokračujú v vyplnení molekulárnych orbitálov.
Najprv je naplnená orbitálna σ1s, Pretože je to najmenšia energia (pravidlo AUFBAUF). Potom musí druhý elektrón dokončiť naplnenie orbitálu σ1s Pred lezením na orbitálnu σ1s* (Pravidlo umývadla). A nakoniec, tento druhý elektrón vedie jeho točenie opačným smerom k prvému elektrónu (princíp vylúčenia Paulingu). Tieto dva elektróny sú teda umiestnené v prepojenom orbitáli σ1s.
A čo objednávka odkazu? V molekulárnom orbitáli linky σ1s Máme 2 elektróny; Zatiaľ čo v molekulárnej orbitálnej orbitáli anti -hell1s* Nemáme žiadne. Preto by výpočet bol:
ani.E = (2-0)/2
= 1
Bytosť alebo.A rovná sa 1, znamená to, že spojenie, ktoré spája dva atómy vodíka, je jednoduché: H-H. Všeobecne platí, že ak sa táto hodnota rovná alebo je väčšia ako 1, hovorí sa, že molekula existuje a je stabilná.
On2
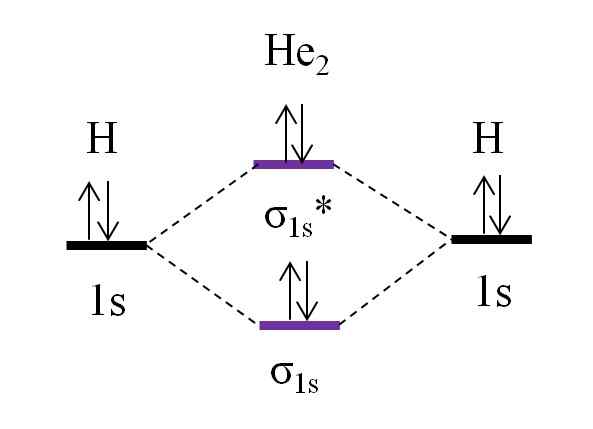 OM Diagram pre hypotetickú dihelio molekulu. Zdroj: Gabriel Bolívar.
OM Diagram pre hypotetickú dihelio molekulu. Zdroj: Gabriel Bolívar. Teraz predpokladajme, že máte molekulu2. Hore vidíme, že jeho diagram OM je veľmi podobný H2, S 2 ďalšími elektrónmi, ktoré sa nachádzajú v orbitáli σ1s*. Ak existuje celkom 4 elektróny, ktoré pridávajú dva atómy, potom musí byť tiež 4 elektróny vo všetkých výsledných molekulárnych orbitáloch.
Určovanie O.E pre ja2 budeme mať:
ani.E = (2-2)/2
= 0
To znamená, že neexistuje možné spojenie, že dva atómy hélia. V skutočnosti doteraz nebola identifikovaná existencia tejto molekuly, ktorá súhlasí s predpovedami molekulárnej orbitálnej teórie.
B2
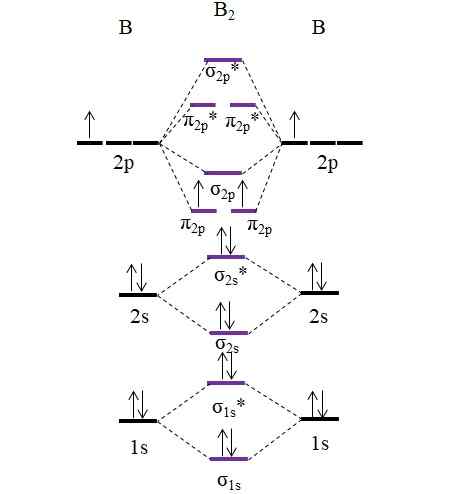 OM Diagram pre molekulu B2. Zdroj: Gabriel Bolívar.
OM Diagram pre molekulu B2. Zdroj: Gabriel Bolívar. Všimnite si, že pri tvorbe molekulárnych orbitálov sa zohľadňujú aj elektróny vnútorných vrstiev; Nielen tie vo Valencii.
Preto v príklade molekuly diboro, b2, Každý atóm bóru prispieva celkovo 5 elektrónov, z ktorých 3 pochádzajú z Valencie; Sú to tie z ich orbitálov 2S a 2p. Dva elektróny orbitálov 2p sú umiestnené na rôznych molekulárnych orbitáloch π2 P S paralelnými chrbticami (pravidlo umývadla).
Potom pokračujeme v výpočte poradia odkazu:
ani.E = (6-4)/2
= 1
Preto sa očakáva, že molekula bude mať jednoduchý odkaz B-B. B2 Je to molekula, ktorá existuje iba v štádiu pary pri veľmi vysokých teplotách, pretože bór v normálnych podmienkach prijíma zložitejšie sieťové štruktúry a návrhy.
C2 a c22-
Zvážte najprv diagram OM pre molekulu C2:
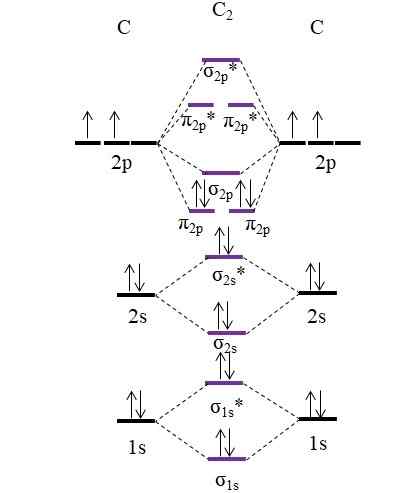 OM Diagram pre molekulu C2. Zdroj: Gabriel Bolívar.
OM Diagram pre molekulu C2. Zdroj: Gabriel Bolívar. Teraz sú dva nové elektróny poskytované atómami uhlíka opäť umiestnené na molekulárnych orbitáloch π2 P Ale s opačným točením (princíp vylúčenia Pauling).
Určenie vašej objednávky odkazu budeme mať:
ani.E = (8-4)/2
= 2
Všimnite si, že molekulárne orbitály π2 P Pridajte 4 elektróny, ktoré sa viažu na vzorec. Keďže tento poriadok sa rovná 2, znamená to, že molekula C2 Má dvojitú väzbu, c = c. Molekula C opäť2, Nazýva sa tiež diatomický uhlík, pri vysokých teplotách je iba parná fáza a je jednou z najjednoduchších alotropných foriem uhlíka.
A čo C22-? Váš OM diagram je nasledujúci:
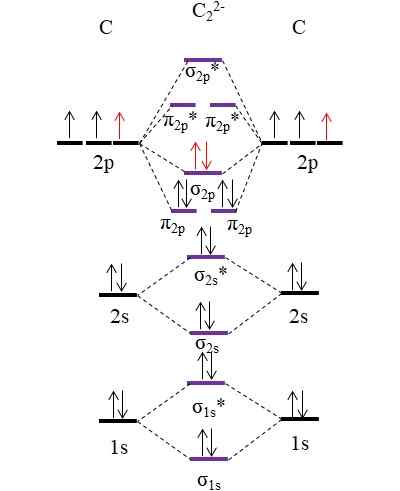 OM Diagram pre anión C22-. Zdroj: Gabriel Bolívar.
OM Diagram pre anión C22-. Zdroj: Gabriel Bolívar. Dva nové elektróny (červené šípky) sú umiestnené v prepojení molekulárnej orbitálnej σ2 P. To sa predpokladá, že každý atóm uhlíka prispieva jedným z dvoch negatívnych nábojov (pre oxidačný stav -1).
Môže vám slúžiť: ortuť fulminate: Štruktúra, vlastnosti, získanie, použitieVýpočet vašej objednávky odkazu budeme mať:
ani.E = (10-4)/2
= 3
To znamená anión C22-, Nazýva sa tiež anión acetyluro, má trojitý odkaz, [C≡C]2-. Je to relatívne stabilný anión s veľkou silou spojenia; V závislosti od svojich náprotivkových iónov však môže pochádzať z výbušných zlúčenín.
N2 a n2+
Slávna molekula dusíka, n2, Dá sa tiež dokonale opísať pomocou molekulárnych orbitálnych diagramov:
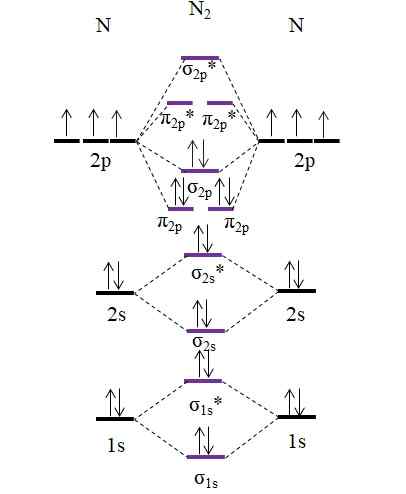 OM Diagram pre molekulu N2. Zdroj: Gabriel Bolívar.
OM Diagram pre molekulu N2. Zdroj: Gabriel Bolívar. Všimnite si, že tento diagram je úplne rovnaký ako pre anión C22-. To znamená, že n2 a c22- Sú izolelektronické. Takáto skutočnosť však neznamená, že oba druhy sa správajú rovnako. N2, neutrálny, je oveľa stabilnejší ako c22-, záporné, aj keď obaja majú poradie odkazu rovnajúce sa 3, n≡n.
A čo katión N2+? Pozrime sa na váš diagram OM:
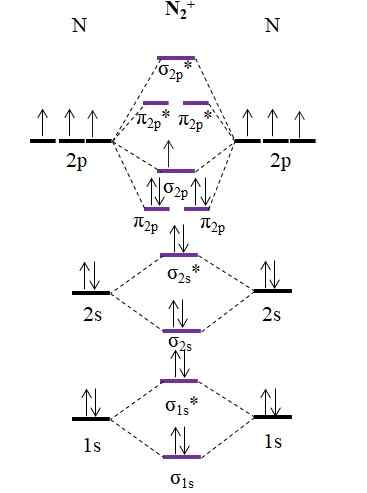 OM Diagram pre katión N2+. Zdroj: Gabriel Bolívar.
OM Diagram pre katión N2+. Zdroj: Gabriel Bolívar. Ako katión N2+ Má o jeden menej elektrón, toto sa odstráni molekulárna orbitálna σ2 P. N2 Je diamagnetický, zatiaľ čo n2+ Je paramagnetický. A jeho poradie odkazu je:
ani.E = (9-4)/2
= 2.5
2 2 odkaz.5 by bolo zastúpené dvoma riadkami a jedným bodom. Takáto vec však nedáva veľký zmysel vo Valenciaovej teórii alebo v Lewisových štruktúrach. Pretože toto poradie odkazu je menšie ako 3, sila spojenia prítomná v n2+ je nižší ako n2, Takže je to nestabilnejšie.
Ani2, Ani22- I22+
Pozrime sa teraz na ďalšiu veľmi dôležitú molekulu pre život: molekulárny alebo diatomický kyslík, alebo2. Podľa Valencieho teórie a Lewisových štruktúr by to malo byť diamagnetické; Ale experimentálne sa ukázalo, že je paramagnetický, takže niekde zmizol elektróny.
Nižšie porovnávame OM diagramy pre O2 a ióny alebo22- (oxid) a o22+ (Oxidácia):
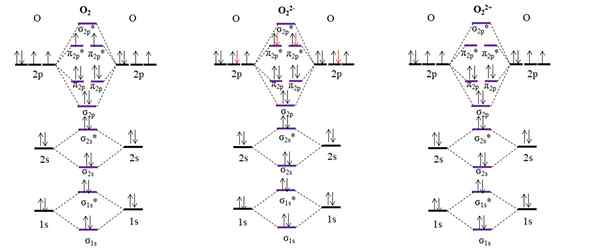 OM diagramy pre molekulárny kyslík a dva z jeho hlavných iónov. Zdroj: Gabriel Bolívar.
OM diagramy pre molekulárny kyslík a dva z jeho hlavných iónov. Zdroj: Gabriel Bolívar. OM diagram pre O2 Vzorka, na rozdiel od predchádzajúcich, že molekulárne orbitály σ2 P a π2 P Zmeňte ich energetickú polohu. Tiež vidíme, že na orbitáloch sú dva chýbajúce elektróny π2 P*, čo vysvetľuje paramagnetický charakter kyslíka (uvedený na začiatku článku).
Na druhej strane, máme tiež diagram OM pre anión alebo22-, nekonečne sa šíria do vesmíru (mesiace, planéty, kométy, asteroidy atď.). Má dva ďalšie elektróny (červené šípky), ktoré dokončia π orbitály2 P*, párenie všetkých elektrónov. Preto alebo22- Je diamagnetický.
Zvažujeme tiež diagram OM na oxidáciu alebo22+. Má dva elektróny menej ako O2, ponechanie prázdnych orbitálov π2 P*. Všetky jeho elektróny sú spárované, a preto je diamagnetický.
Prepojiť objednávky pre O2, Ani22- I22+ Sú to: 2 (o = o), 1 [o-o]2- a 3 [o≡o]2+. Preto O22+ by mal najsilnejší odkaz.
Výhody a nevýhody
Výhody
Medzi výhodami molekulárnej orbitálnej teórie môžeme citovať nasledujúce:
-Umožňuje vyhodnotiť príkazy na prepojenie, že obyčajné by nedali zmysel v teórii Link Valencia Link
-Dobre koreluje s diamagnetizmom a paramagnetizmom molekúl
-Vzdialenosť, ktorá oddeľuje molekulárne orbitály v diagramoch, sa rovná AE a slúži na vysvetlenie elektronických prechodov produktom absorpcie fotónov
-Uplatňuje nielen homonukleárne diatomické molekuly, ale aj pre heteronukleárne molekuly, ako je CO2 a benzén
-Rozširuje svoj model smerom k iným typom zlúčenín, ako sú anorganické komplexy, takže podporuje teóriu oblasti ligandov
-Zohľadnenie, že elektróny sa premiestnia v celej molekule, je vhodné vysvetliť mnohé fyzikálno -chemické vlastnosti
Nevýhody
A medzi niektorými nevýhodami molekulárnej orbitálnej teórie, ktorú musíme skončiť:
-Je to veľmi abstraktné a vyžaduje hlboké matematické porozumenie, aby sa mu úplne porozumelo
-Molekulačné diagramy ako co2, Co, h2Alebo a iní, môžu byť príliš únavní na to, aby sa rozpracovali a vysvetlili
-Hovorí nič o konkrétnych regiónoch alebo odkazoch veľkej molekuly
-Neposkytuje ani žiadne informácie týkajúce sa molekulárnej geometrie (trigonálna rovina, štvorcová rovina, tetraedrálna atď.).
-Nie je to také grafické ako Valenciaova teória odkazov
Molekulárna orbitálna teória je na záver teória, ktorá dopĺňa teóriu odkazu Valencia, aby mala širšiu a úplnejšiu panorámu molekulárneho spektra.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Orbitálna molekulárna teória. Zdroj: In.Wikipedia.orgán
- Stephen nižší. (7. september 2020). Orbitálna molekulárna teória. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Steven a. Hardinger. (2017). Orbitálna molekulárna teória. Zdroj: Chemed.Chem.Purdue.Edu
- Tlačové knihy. (s.F.). Kapitola 8: Orbitálna molekulárna teória. Zdroj: OpenTextBC.Ac

