Teória mora elektrónov Základy a vlastnosti
- 2283
- 711
- Václav Višňovský
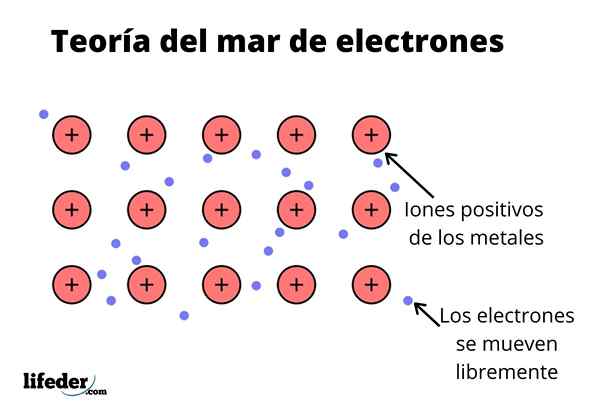
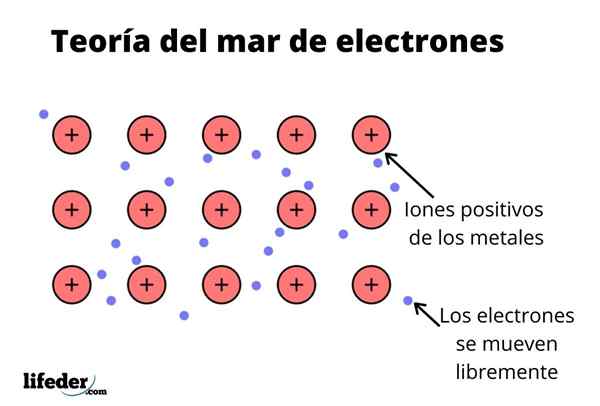
Ten Teória elektrónového mora Je to hypotéza, ktorá vysvetľuje výnimočný chemický jav, ktorý sa vyskytuje v kovových väzbách medzi prvkami s nízkymi elektronegativitami. Toto je zdieľanie elektrónov medzi rôznymi zjednotenými atómami prostredníctvom kovových väzieb.
Elektronická hustota medzi týmito väzbami je taká, že elektróny sú premiestnené a tvoria „more“, kde sa pohybujú voľne. Môže sa tiež vyjadriť kvantovou mechanikou: niektoré elektróny (zvyčajne sú jeden až sedem na atóm) sú usporiadané na orbitáloch s viacerými centrami, ktoré sú natiahnuté kovovým povrchom.
Elektróny si tiež zachovávajú určité miesto v kovu, hoci distribúcia pravdepodobnosti elektronického oblaku má okolo niektorých špecifických atómov väčšiu hustotu. Je to preto, že keď sa uplatňuje konkrétny prúd, prejavujú svoju vodivosť konkrétnym smerom.
[TOC]
Základy teórie elektrónového mora
Kovové prvky majú veľkú tendenciu darovať elektróny svojej najnovšej hladiny energie (valenčná vrstva), kvôli ich nízkej ionizačnej energii vo vzťahu k ostatným prvkom.
Vedieť to, každý kovový prvok by sa mohol považovať za katión spojený s elektrónom jeho poslednej energetickej úrovne, ktorý by bol náchylnejší na darovanie.
Rovnako ako v kovu je veľké množstvo atómov, ktoré sú navzájom spojené, možno predpokladať, že tento kov tvorí skupinu kovových katiónov, ktoré sa vrhajú do druhu mora valenčných elektrónov, ktoré majú veľké premiestnenie.
Vzhľadom na to, že elektrostatické príťažlivé sily medzi katiónom (pozitívne zaťaženie) a elektrónom (záporné zaťaženie) majú silne spojené atómy kovu, predstavte si premiestnenie valenčných elektrónov, ktoré sa správajú ako elektrostatické lepidlo, ktoré zachováva spojené s kovovými katiónmi.
Môže vám slúžiť: polyméryTýmto spôsobom je možné vyvodiť, že čím väčší počet elektrónov prítomných vo valencia vrstve kovu, tento druh elektrostatického lepidla bude mať väčšiu pevnosť.
Vlastnosti
Teória elektrónového mora ponúka jednoduché vysvetlenie charakteristík kovových druhov, ako je odolnosť, vodivosť, ťažnosť a kladitnosť, ktoré sa líšia od jedného kovu k druhému.
Zistilo sa, že rezistencia udelená kovom je spôsobená veľkým premiestnením ich elektrónov, čo vytvára veľmi vysokú kohéznu silu medzi atómami, ktoré ju tvoria.
Týmto spôsobom je ťažnosť známa ako schopnosť určitých materiálov umožniť deformáciu ich štruktúry, bez toho, aby sa dostalo na to, aby sa zlomili, keď sú vystavené určitým silám.
Delokalizácia vo forme vrstiev
Tam, ako aj kovová kovová, určujú skutočnosť, že elektróny vo Valencii sú demokované vo všetkých smeroch vo forme vrstiev, čo ich robí navzájom pred pôsobením vonkajšej sily, čím sa zabráni rozpadu kovovej konštrukcie, ale umožňuje ich povolenie jeho deformácia.
Podobne aj sloboda pohybu premiestnených elektrónov umožňuje tok elektrického prúdu, čo spôsobuje, že kovy majú veľmi dobrú vodivosť elektriny.
Okrem toho tento jav voľného pohybu elektrónov umožňuje prenos kinetickej energie medzi rôznymi kovovými oblasťami, čo podporuje prenos tepla a robí kovy prejavujúce veľkú tepelnú vodivosť.
Môže vám slúžiť: kyselina jodóza (HIO2): Vlastnosti a použitiaTeória elektrónov mora v kovových kryštáloch
Kryštály sú pevné látky, ktoré majú fyzikálne a chemické vlastnosti - ako bod hustoty, topenia a tvrdosti - ktoré sú stanovené druhmi síl, ktoré vytvárajú častice, ktoré ich tvoria.
Svojím spôsobom sa predpokladá, že kovové kryštály majú najjednoduchšie štruktúry, pretože každý „bod“ sklenenej siete bol obsadený atómom samotného kovu.
V tom istom zmysle sa zistilo, že štruktúra kovových kryštálov je vo všeobecnosti kubická a zameriava sa na tváre alebo telo.
Tieto druhy však môžu mať tiež hexagonálny tvar a majú pomerne kompaktné balenie, čo im dáva obrovskú hustotu, ktorá je pre nich charakteristická.
Z tohto štrukturálneho dôvodu sa odkazy, ktoré sa tvoria v kovových kryštáloch. V celej kryštalickej štruktúre sa predtým vysvetľujú elektróny, ktoré môžu tvoriť väzby, ako je vysvetlené vyššie.

Nevýhody teórie
V atómoch kovov je malé množstvo valenčných elektrónov v pomere k ich hladine energie; To znamená, že existuje väčšie množstvo energetických stavov ako množstvo prepojených elektrónov.
To znamená, že keďže existuje silné elektronické premiestnenie a tiež energetické pásy, ktoré sa čiastočne naplnia, elektróny sa môžu pohybovať cez retikulárnu štruktúru, keď sú vystavené elektrickému poľu zo zahraničia, okrem vytvorenia elektrónového oceánu, ktorý pripúšťa priepustnosť sieť.
Môže vám slúžiť: OxácidoPreto sa spojenie kovov interpretuje ako konglomerát pozitívnych iónov spojených s morom elektrónov (negatívne zaťaženie).
Existujú však charakteristiky, ktoré sa prostredníctvom tohto modelu nevysvetľujú, napríklad tvorba určitých zliatin medzi kovmi so špecifickými kompozíciami alebo stabilitou kolektívnych kovových väzieb.
Tieto nepríjemnosti sú vysvetlené kvantovou mechanikou, pretože táto teória aj mnoho ďalších prístupov boli stanovené na základe najjednoduchšieho modelu jedného elektrónu, pričom sa snažia aplikovať v oveľa zložitejších štruktúrach multielektronických atómov.
Odkazy
- Wikipedia. (2018). Wikipedia. Získaný z.Wikipedia.orgán
- Holman, J. Siež., A kameň, p. (2001). Chémia. Zotavené z kníh.Riadenie.co.ísť
- Parkovisko. (2010). Prilepenie kovov. Zotavené z kníh.Riadenie.co.ísť
- Rohrer, G. Siež. (2001). Štruktúra a väzba v kryštalických materiáloch. Zotavené z kníh.Riadenie.co.ísť
- Ibach, h., a lüth, h. (2009). Fyzika v tuhom stave: Úvod do princípov materiálovej vedy. Zotavené z kníh.Riadenie.co.ísť
- « Proces, typy a príklady kultúrnej hybridizácie
- 20 turistických miest Aguascalientes (fotografie) »

