Aromatické nukleofilné účinky substitúcie, príklady
- 1019
- 38
- Alan Milota
Ten Aromatická nukleofilná náhrada (SNAR) je reakcia, ktorá sa vyskytuje v organickej chémii, ktorá spočíva v vysídlení dobrej odchádzajúcej skupiny prichádzajúcim nukleofilom. Z hľadiska jeho mechanizmu a elektronických aspektov je opačnou tvárou aromatickej elektrofilnej substitúcie (SEAR).
Všeobecne platí, že odchádzajúca skupina je halogén, ktorý vychádza ako haluro x anión-. Táto reakcia sa môže uskutočniť iba vtedy, ak je aromatický kruh (väčšinou benzén) nedostatočný v elektronoch; to znamená, že ak máte skupiny substituujúcich atraktorov elektrónov.
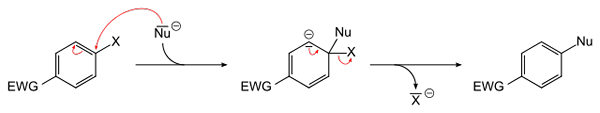
 Všeobecná rovnica pre aromatickú nukleofilnú substitúciu. Zdroj: Sponk [verejná doména]
Všeobecná rovnica pre aromatickú nukleofilnú substitúciu. Zdroj: Sponk [verejná doména] Superior Image schéma obsahuje to, čo bolo povedané v predchádzajúcom odseku. Skupina EWG Electron Atchor Group (pre svoju skratku v angličtine: Elektrónka), aktivuje aromatický kruh na nukleofilný útok negatívnych druhov NU-. Je zrejmé, že sa vytvorí sprostredkovateľ (v strede), z ktorého je Haluro X prepustený alebo prepustený-.
Všimnite si, že v jednoduchých X sa nahradí nu v aromatickom kruhu. Táto reakcia je veľmi univerzálna a potrebná pri syntéze nových liekov, ako aj v štúdiách syntetickej organickej chémie.
[TOC]
Všeobecné vlastnosti
Aromatický krúžok môže byť „nabitý“ alebo „sťahovať“ z elektrónov v závislosti od toho, čo sú ich substituenty (tí, ktorí nahrádzajú pôvodný odkaz C-H).
Keď títo substituenti môžu darovať elektronickú hustotu kruhu, hovorí sa, že ju obohacujú z elektrónov; Ak naopak, sú to atraktory elektronickej hustoty (vyššie uvedené EWG), potom sa hovorí, že ochudobňujú elektrónový kruh.
V každom prípade je krúžok aktivovaný pre špecifickú aromatickú reakciu, zatiaľ čo je deaktivovaný pre druhú.
Napríklad aromatický kruh bohatý na elektróny je považovaný za aktívny pre aromatickú elektrofilnú substitúciu; To znamená, že môžete darovať svoje elektróny elektrofilovanému druhu a+. Nebude však darovať elektróny druhu NU-, Pretože negatívne obvinenia by sa navzájom odrazili.
Môže vám slúžiť: molekulárna orbitálna teóriaTeraz, ak je prsteň slabý v elektronoch, nemá to, ako ich dať druhu a+ (Sear sa nevyskytuje); Namiesto toho je dostupnosťou akceptovať elektróny druhov NU- (SNAR sa vyvíja).
Rozdiely s aromatickou elektrofilnou substitúciou
Objasnili všeobecné aspekty vstupu, niektoré rozdiely medzi SNAR a Sear je teraz uvedené:
- Aromatický kruh pôsobí ako elektrofil (zlé elektróny) a je napadnutý nukleofilom.
- Z kruhu sa nahradí odchádzajúca skupina X; Nie h+
- Nezohľadňujú sa žiadne karbocations, ale sprostredkovatelia s negatívnym nábojom, ktorý sa dá premiestniť rezonanciou
- Prítomnosť atraktívnejších skupín v kruhu zrýchľuje substitúciu namiesto toho, aby ju spomalila
- Nakoniec tieto skupiny nevykonávajú riaditelia, kde (v ktorej uhlíku) dôjde k výmene. Výmena sa vždy vyskytne v uhlíku spojenom s odchádzajúcou skupinou X.
Posledný bod je tiež ilustrovaný v obrázku: odkaz C-X je zlomený, aby sa vytvoril nový odkaz C-Nu.
Účinky
Počtu substituentov
Prirodzene, chudobnejším v elektronoch je prsteň, tým rýchlejšie je Snar a najmenej drastickými podmienkami potrebnými na to, aby sa vyskytli. Zvážte nasledujúci príklad znázornený v dolnom obrázku:
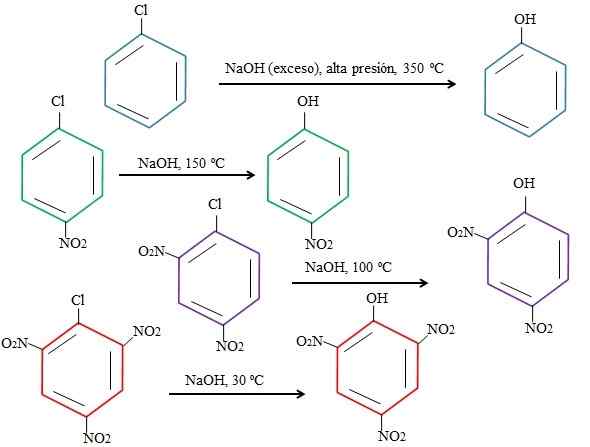 Účinky substituentov na substitúcie 4-nitroklórbenzénu. Zdroj: Gabriel Bolívar.
Účinky substituentov na substitúcie 4-nitroklórbenzénu. Zdroj: Gabriel Bolívar. Všimnite si, že 4-nitroklórbenzén (modrý kruh) vyžaduje drastické podmienky (vysoký tlak a teplota 350 ° C) na výmenu Cl. V tomto prípade je chlór odchádzajúcou skupinou (CL-) a nukleofilový hydroxid (OH-).
Môže vám slúžiť: 4 obdobia chémie: Od praveku až do dnešného dňaKeď sa skupina neobjaví2, čo je elektrónový atraktor (zelený kruh), substitúcia sa môže vykonávať pri teplote 150 ° C pri okolitom tlaku. Ako počet skupín zvyšuje č2 prítomné (fialové a červené krúžky), výmena sa uskutočňuje pri stále nižšej teplote (100 ° C a 30 ° C).
Preto skupiny nie2 Urýchľujú Snar a nezmenia sa z elektrónov do kruhu, vďaka čomu je náchylnejší na útok OH-.
Relatívne polohy CL sa tu nebudú vysvetliť s ohľadom na nie2 v 4-nitroklórbenzéne a ako menia rýchlosť reakcie; Napríklad reakčné rýchlosti 2-nitroklorbenzénu a 3-nitrochlórbenzénu sú rôzne, pričom posledne menované sú najpomalšie v porovnaní s ostatnými izomérmi.
Odchádzajúcej skupiny
Po návrate do 4-nitroklóromenzénu je jeho substitučná reakcia pomalšia, ak porovnáte reakciu vášho fluórovaného náprotivku:
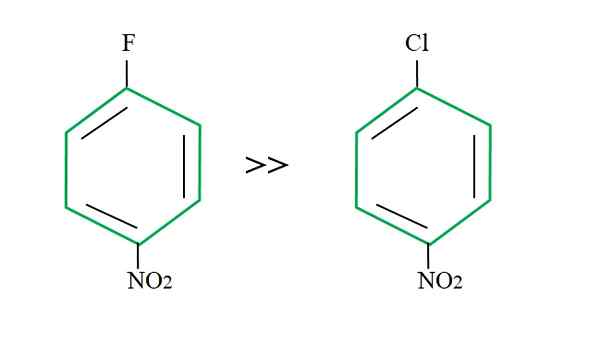 Vplyv odchádzajúceho skupiny na reakcie SNAR. Zdroj: Gabriel Bolívar.
Vplyv odchádzajúceho skupiny na reakcie SNAR. Zdroj: Gabriel Bolívar. Vysvetlenie tohto. Fluór je mizerná odchádzajúca skupina, pretože odkaz C-F je ťažšie prelomiť ako odkaz C-Cl. Zlomenie tohto odkazu preto nie je určujúcim krokom rýchlosti pre Snar, ale pridanie NU- do aromatického kruhu.
Fluór pre viac elektronegatívneho ako chlór, atóm s uhlíkom s ním má väčší elektronický nedostatok (CΔ+-FΔ-). V dôsledku toho je uhlík spojenia C-F oveľa pravdepodobnejšie, že napadne NU- ako c-cl odkaz. Preto je nahradenie F od OH oveľa rýchlejšia ako Cl OH.
Môže vám slúžiť: Sulfid meďnatého: Štruktúra, vlastnosti, použitiePríklad
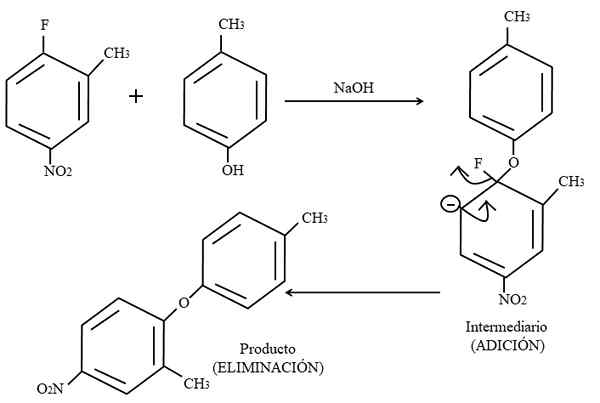 Aromatická elektrofilná výmena. Zdroj: Gabriel Bolívar.
Aromatická elektrofilná výmena. Zdroj: Gabriel Bolívar. Nakoniec je uvedený príklad tohto typu organických reakcií vo vyššom obrázku nižšie. Para-Coresol nedáva vzhľad nukleofilu; Ale s základným médiom je jeho OH skupina nechránená a zanecháva fenoxidový anión, ktorý útočí na 2-metyl-4-nitrofluorzén.
Keď dôjde k tomuto útoku, hovorí sa, že nukleofil sa pridá do elektrofilu. Tento krok je možné vidieť napravo od obrázka, kde sa vytvorí sprostredkovateľská zlúčenina s oboma substituentmi patriacimi k krúžku.
Pridaním para-koresolu sa objaví záporné zaťaženie, ktoré premiestni rezonanciu vo vnútri kruhu (všimnite si, že prestane byť aromatický).
Na obrázku je najnovšia rezonančná štruktúra sotva zobrazená, z ktorej je fluorid dokončený ako f-; Ale v skutočnosti sa toto negatívne zaťaženie stáva disakcuppiou aj v atómoch kyslíka skupiny2. Po pridaní eliminácie, posledný, ktorý je v čase, keď sa produkt konečne vytvorí.
Konečný komentár
Skupina č2 Zostávajúca sa dá zredukovať na skupinu NH2, A odtiaľ je možné urobiť viac syntéznych reakcií na modifikáciu konečnej molekuly. To ukazuje syntetický potenciál SNAR a že jeho mechanizmus navyše pozostáva z dvoch krokov: jeden z pridania a jeden z eliminácie.
V súčasnosti však existujú experimentálne a výpočtové dôkazy, že v skutočnosti reakcia prebieha po spoločnom mechanizme, kde oba kroky sa vyskytujú súčasne prostredníctvom aktivovaného komplexu a nie sprostredkovateľa.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.
- Wikipedia. (2019). Nukleofilná aromatická substitúcia. Zdroj: In.Wikipedia.orgán
- James Ashenhurst. (6. september 2019). Nukleofilná aromatická substitúcia (NAS). Získané z: Masterorganicchemistry.com
- Chémia librettexts. (5. júna 2019). Nukleofilná aromatická substitúcia. Získané z: Chem.Librettexts.orgán

