Aromatický elektrofilný substitučný mechanizmus a príklady

- 4407
- 298
- Alfréd Blaho
Ten Aromatická elektrofilná náhrada (Sear) Je to organická reakcia, pri ktorej zlý druh v elektronoch, tj elektrofle, nahrádza jeden z vodít aromatického kruhu. Táto reakcia je proti prídavkom, ktoré utrpeli alkény, čo dokazuje účinok aromaticity na reaktivity benzénu a jeho derivátov.
Elektrofil, mnohokrát sa vytvára počas toho istého molekulárneho mechanizmu, produkt zmesi reagencií a katalyzátora, ktorý pozostáva z kyseliny Lewisu, napríklad všetkých3 alebo fecl3. Tieto katalyzátory zvyšujú aviditu elektrofilu elektrónmi aromatického kruhu, čím sa zrýchľuje reakcia.
 Pri aromatickej elektrofilnej substitúcii je to benzénový kruh, ktorý útočí na elektrofilu. Zdroj: Gabriel Bolívar cez Molview.
Pri aromatickej elektrofilnej substitúcii je to benzénový kruh, ktorý útočí na elektrofilu. Zdroj: Gabriel Bolívar cez Molview. Na vynikajúcom obraze máme jednoduché znázornenie elektrofilného útoku benzénu smerom k elektrofilu a+. Všimnite si, že útok pochádza z elektrónov jedného z jeho dvojitých väzieb; to znamená, že začínajú elektróny konjugovaného systému π.
Táto reakcia umožňuje, aby benzén a iné aromatické zlúčeniny získali substituenty, ako sú OH skupiny, nie2, SW3H, Cl, Br, R, Cor, Coch3, medzi inými. Napríklad fenol sa syntetizuje pomocou pátra od benzénu a ďalších derivátov.
[TOC]
Aromatický elektrofilný substitučný mechanizmus
Krok 1: Elektrofylický útok
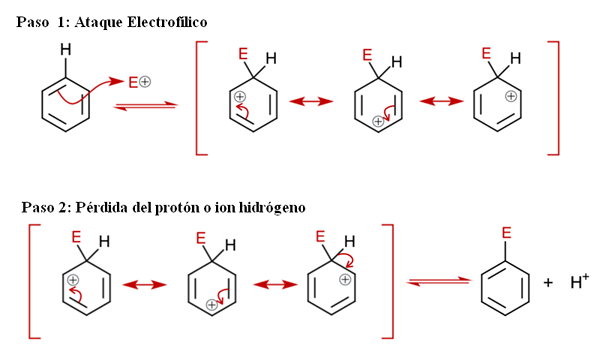 Všeobecný mechanizmus pre pálenie. Zdroj: Soonlorpai Via Wikipedia.
Všeobecný mechanizmus pre pálenie. Zdroj: Soonlorpai Via Wikipedia. Na vynikajúcom obraze je mechanizmus aromatickej elektrofilnej substitúcie podrobnejšie znázornený. Ktorý z troch dvojitých väzieb benzénu útočí na elektrofil a+, Na vytvorenie sprostredkovateľských druhov známych ako ión Arenio (delokalizovaný cyklohexadien), uzamknutý v červených držiakoch.
Môže vám slúžiť: chemické zrážkyVšimnite si, že kladné zaťaženie e+ Teraz sa presuňte do interiéru kruhu. Ale nielen to: presídlí sa medzi tri atómy uhlíka v ortho (susedných) pozíciách a (naopak) ako uhlík spojený s E (C-E). Tento sprostredkovateľ existuje presne vďaka stabilite udelenej jeho rezonančnými štruktúrami.
Krok 2: Strata protónového alebo vodíkového iónu
Avšak ión musí čoskoro neutralizovať svoje pozitívne zaťaženie stratou vodíkového protónu alebo iónu. Tu vyvrcholilo výmenu. Elektrofil e+ preto nahrádza jeden z benzénových vodíkov a zanecháva to ako ión h+ mimo kruhu, aby sa zachovali pozitívne poplatky.
Ak sa pozorne pozoruje, všetky kroky sú v rovnováhe, takže náhrada je reverzibilná. To znamená, že ak sa zvýšia koncentrácie H+, potom vodík nahradí E a znova získame reagencie.
Príklady aromatickej elektrofilnej substitúcie
Benzén
Benzénový sear je najjednoduchší zo všetkých, už uvedené vyššie. Ktorýkoľvek z hydrogénov môže byť nahradený e+, Pretože všetky sú chemicky rovnocenné.
Neexistujú od seba žiadne rozdiely. Preto je pravdepodobnosť, že výmena nastane v jednom zo šiestich atómov uhlíka. Všetko sa však mení, keď sú v benzénom kruhu prítomné aj ďalšie substituenty, ako uvidíme nižšie.
Fenol
Ortho, za útoky na bránky
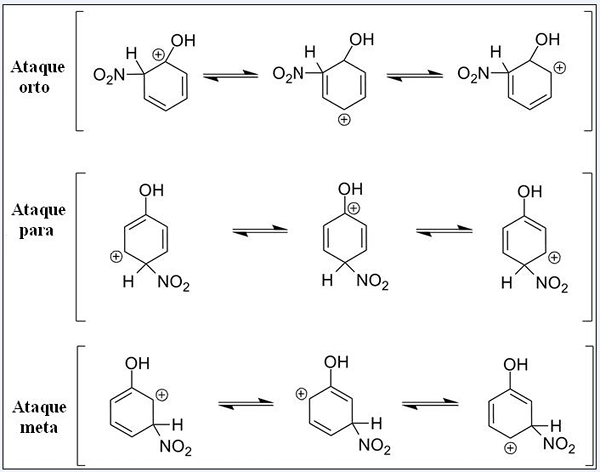 Rezonančné štruktúry pre fenol v jeho aromatickej elektrofilnej substitučnej reakcii. Zdroj: Pete Davis, verejná doména, cez Wikimedia Commons
Rezonančné štruktúry pre fenol v jeho aromatickej elektrofilnej substitučnej reakcii. Zdroj: Pete Davis, verejná doména, cez Wikimedia Commons Zvážte teraz pálenie pre fenol. Tentokrát je elektrofiami nitrónskym katiónom, nie2+, ktoré sa pri prepojení na benzénový kruh transformuje do skupiny nitro, -No2.
Môže vám slúžiť: dusičnany: vlastnosti, štruktúra, nomenklatúra, školenieTeraz, keď je prítomná skupina OH, ostatné vodíny prestanú byť chemicky ekvivalent; Niektoré sú náchylnejšie na výmenu ako iné. A navyše, OH má v tomto bode priamy vplyv.
Až máme tri substitúcie v rôznych pozíciách týkajúcich sa OH: Ortho útoky, za cieľ a cieľ. Všimnite si, že vo všetkých troch máme Sandy katión a jeho rezonančné štruktúry. Pri orto útokoch a pre kladné zaťaženie vo vnútri benzénového kruhu sa nachádza priamo v uhlíku spojenom s OH; Zatiaľ čo v cieľovom útoku sa tak nestane.
Ach ako ortho skupina a pre režiséra
OH predstavuje schopnosť poskytovať elektróny do kruhu pomocou rezonancie a indukcie. V obidvoch môže pomôcť „rozptýliť“ kladné zaťaženie uhlíka, s ktorým je spojený, a podľa toho stabilizuje štruktúra. Naopak, keď dôjde k cieľovému útoku, OH nemôže stabilizovať pozitívne zaťaženie rovnakým spôsobom, štruktúra je nestabilnejšia.
Preto orto útoky a pre väčšiu zvýhodnenú energiu. Potom sa hovorí, že OH je orto-for režisérska skupina, ktorá môže tiež aktivovať benzénny prsteň smerom k Sear. To znamená, že fenol reaguje oveľa rýchlejšie ako benzén, čo je demonštrované meraním reakčných rýchlostí.
Arilamíny
 Rezonančné štruktúry pre anilín v jeho aromatickej elektrofilnej substitučnej reakcii. Zdroj: V8rik v angličtine Wikipedia, CC BY-SA 3.0, cez Wikimedia Commons
Rezonančné štruktúry pre anilín v jeho aromatickej elektrofilnej substitučnej reakcii. Zdroj: V8rik v angličtine Wikipedia, CC BY-SA 3.0, cez Wikimedia Commons Prípad arilamínov, ako je prípad anilínu (vynikajúci obraz), je podobný ako v prípade fenolu. Všimnite si, že vo svojom mechanizme tentoraz stabilizácia pozitívneho zaťaženia atómu dusíka (H2N+=), pomáha substitúcii orientovať sa na orto pozície a pre, ako v prípade OH.
Môže vám slúžiť: teórie kyseliny: Arrhenius, Bronsted Lowry, LewisTeraz je anilín reaktívnejší ako fenol proti elektrofilnej substitúcii. Pretože? Pretože atóm dusíka je menej elektronegatívny ako atmosgén, a preto dáva svojim párom voľných elektrónov ľahšie aromatický kruh. Kyslík, pretože je viac elektronegatívny, poskytuje jeden z jeho elektrónových párov s menšou „aviditou“.
Tiež atómový polomer dusíka je bližšie k veľkosti uhlíka. To má vplyv na skutočnosť, že rezonancia sa uskutočňuje najmä medzi atómami s podobnými rádiami alebo veľkostiami. Preto je rezonancia medzi uhlíkom a dusíkom o niečo stabilnejšia a účinnejšia ako medzi uhlíkom a kyslíkom.
Chlórbenzén
Na druhej strane v chlórbenzéne atóm CL spomaľuje substitúciu kvôli jeho elektronegativite. A hoci je tiež schopný darovať elektróny v dôsledku rezonancie k krúžku, jeho atómový polomer je podstatne väčší ako uhlík, a preto znižuje uvedený elektronický príspevok.
V reakcii chlórbenzén reaguje 50 -krát pomalšie ako benzén, pretože jeho krúžok je deaktivovaný kvôli chlóru. A tiež priťahovanie elektrónov k sebe je chlór cieľová skupina, takže v tejto polohe sa vyskytujú substitúcie prevažne v tejto polohe.
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10th Vydanie.). Wiley Plus.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Morrison a Boyd. (1987). Organická chémia. (Piate vydanie). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Aromatická zlúčenina. Zdroj: In.Wikipedia.orgán
- Ed Vitz a kol. (8. september 2020). Aromatické uhľovodíky. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Wyman Elizabeth. (2020). Aromatické uhľovodíky: Definícia, príklad a použitie. Štúdium. Získané z: štúdie.com
- Boluda, C. J., Macías, m., & González Marrero, J. (2019). Chemická zložitosť automobilového benzínu. Veda, inžinierstvo a aplikácie,2(2), 51-79. Doi: doi.org/10.22206/cyap.2019.V2i2.Pp51-79
- « Charakteristiky tepelnej energie, získanie, prenos
- Štruktúra oxidu hliníka, vlastnosti, použitie, nomenklatúra »

