Dodávajte rôzne charakteristiky, štruktúru, funkcie
- 2780
- 494
- Alan Milota
Ten Dysmutas superoxid (Sliesk) buď oxidovaný superoxid, Vytvárajú rodinu všadeprítomných enzýmov v prírode, ktorých hlavná funkcia spočíva v obrane aeróbnych organizmov proti radikálom bez kyslíka, najmä aniónových radikálov superoxidov.
Reakcia, ktorú tieto enzýmy katalyzujú, sa vyskytuje prakticky vo všetkých bunkách, ktoré sú schopné dýchať (aerobik) a je nevyhnutná pre ich prežitie, pretože eliminuje radikálnu toxickú látku bez kyslíka, a to v eukaryotoch aj v prokaryotoch.
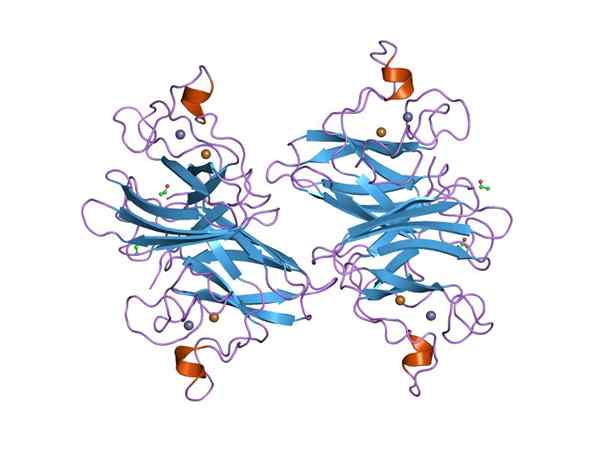
 Grafické znázornenie superoxidu Dymputázy (SOD) Cu-Zn (zdroj: Jawahar Swaminathan a MSD zamestnancov v Európskom bioinformatickom inštitúte [verejná doména] prostredníctvom Wikimedia Commons) prostredníctvom Wikimedia Commons)
Grafické znázornenie superoxidu Dymputázy (SOD) Cu-Zn (zdroj: Jawahar Swaminathan a MSD zamestnancov v Európskom bioinformatickom inštitúte [verejná doména] prostredníctvom Wikimedia Commons) prostredníctvom Wikimedia Commons) Mnoho chorôb u zvierat súvisí s akumuláciou rôznych reaktívnych druhov kyslíka a to isté platí pre rastliny, pretože prostredie ukladá početné a konštantné typy oxidačného stresu, ktoré sa prekonávajú vďaka aktivite rozpadnutia superoxidu.
Túto skupinu enzýmov objavili v roku 1969 McCord a Fridovich a odvtedy sa dosiahli značné pokroky týkajúce sa týchto enzýmov a reakcií, ktoré katalyzujú v živých bytostiach.
[TOC]
Charakteristika
Dysmutas superoxid reaguje so superxidovými radikálmi na skutočne vysoké rýchlosti, čo sa premieta do veľmi účinnej obrannej línie na odstránenie týchto molekúl.
U cicavcov boli opísané najmenej tri izoformy pre nadmerroxid dysmutázu známu ako SOD1, SOD2 a SOD3, respektíve.
Dva z týchto izoforiem majú vo svojich katalytických centrách atómy medi a zinku a líšia sa navzájom, pokiaľ ide o ich umiestnenie: intracelulárne (cytosolické, SOD1 alebo Cu/Zn-SOD) alebo s extracelulárnymi prvkami (EC-SOD alebo SOD3).
Izoforma SOD2 alebo MN-SOD, na rozdiel od predchádzajúcich dvoch, má atóm mangánu ako kofaktor a jeho poloha sa zdá byť obmedzená na mitochondrie aeróbnych buniek.
Izoenzýmy SOD1 sú hlavne v cytosóle, hoci boli detegované aj v jadrovom kompartmente a lyzozómoch. Naopak, SOD 3 izoenzýmy boli opísané v krvnej plazme ľudí, v lymfatických a mozgových tekutinách.
Môže vám slúžiť: Ako sa v priebehu času menia živé bytosti?Každá z týchto izoforiem je kódovaná rôznymi génmi, ale patriaci do tej istej rodiny a jej transkripčná regulácia je v podstate kontrolovaná extra-intracelulárnymi podmienkami, ktoré vyvolávajú rôzne vnútorné signalizačné vodopády.
Ďalší dekrivý superoxid
Dysmonický superoxid s katalytickými miestami, ktoré majú medené a zinkové alebo mangánové ióny.
Existuje ďalšia skupina superoxidu dysmutasu, ktorá sa nenachádza u cicavcov a ktoré sú ľahko rozpoznateľné, pretože na svojom aktívnom mieste majú železo namiesto ktoréhokoľvek z troch predtým opísaných pre ostatné triedy dysmatózneho superoxidu.
V A. coli, Dysmi nadmeroxidu, ktorý obsahuje železo, je perplastický enzým tiež zodpovedný za detekciu a elimináciu radikálov bez kyslíka generované počas dýchania. Tento enzým je podobný enzýmu, ktorý sa nachádza v mitochondriách mnohých eukaryotov.
Rastliny majú tri typy enzýmov: tie, ktoré obsahujú meď a zinok (Cu/Zn-SOD), ktoré obsahujú mangán (MN-SOD) a tie, ktoré obsahujú železo (FE-SOD) v ich aktívnom centre a v týchto organizmoch, ktoré cvičia Analogické funkcie s funkciami nevegetálnych enzýmov.
Reakcia
Substráty enzýmu dysmy-superoxidu sú anióny superoxidov, ktoré sú znázornené ako O2- a ktoré sú v procese redukcie kyslíka v procese redukcie kyslíka.
Reakcia, ktorú katalyzujú, sa dajú predpokladať vo všeobecných líniách, ako je transformácia (spor) voľných radikálov na tvorbu molekulárneho kyslíka a peroxidu vodíka, ktoré sa uvoľňujú do životného prostredia alebo zamestnancov ako substrát z iných enzýmov.
Môže vám slúžiť: glukány: štruktúra, charakteristiky a funkciePeroxid vodíka sa môže následne eliminovať z buniek vďaka pôsobeniu ktoréhokoľvek z enzýmov, ale peroxidázy a katalázy glutatión, ktoré tiež vykonávajú dôležité funkcie pri ochrane buniek.
Štruktúra
Dysmutas superoxidové izoenzýmy u ľudí sa môžu navzájom líšiť, pokiaľ ide o určité štrukturálne aspekty. Napríklad izoenzým SOD1 je molekulová hmotnosť 32 kDa, zatiaľ čo SOD2 a SOD3 sú homotetice molekulovej hmotnosti 95 a 135 kDa.
Ďalšou skupinou dysmatózneho superoxidu, Fe-SOD prítomného v rastlinách a iných organizmoch ako cicavce, sú enzýmy dimérárok identických podjednotiek, to znamená, že sú homodimérmi.
V niektorých rastlinách tieto FE-SOD obsahujú predpokladanú N-terminálnu signálnu sekvenciu pre transport vo vnútri chloroplastov a iné obsahujú transport Triquer Transport C-terminálnej sekvencie s peroxizómmi, takže sa predpokladá, že jej subcelulárne distribúcia je obmedzená obidva kompartmenty.
Molekulárnu štruktúru troch typov enzýmov nadmerného exex sa v podstate konzultuje s vrtuľami Alpha a B-Tolled Lisets.
Funkcia
Dysmonický superoxid bráni bunky, orgány a telesné tkanivá škody, ktoré môžu radikály bez kyslíka spôsobiť, ako peroxidácia lipidov, denaturácia proteínov a mutagenéza DNA.
U zvierat môžu tieto reaktívne druhy spôsobiť srdcové lézie, urýchliť starnutie a zúčastňovať sa na rozvoji zápalových chorôb.
Rastliny tiež vyžadujú základnú enzymatickú aktivitu nadmernej oxidu dysmutázy, pretože veľa stresujúcich podmienok životného prostredia zvyšuje oxidačný stres, to znamená koncentráciu deleleróznych reaktívnych druhov.
U ľudí a iných cicavcov majú tri izoformy opísané pre dysmutázu nadmeroxidu rôznych funkcií. Izoenzým SOD2 sa napríklad podieľa na diferenciácii buniek a tumorogenéze a tiež na ochrane pred hyperoxiou vyvolanou pľúcnou toxicitou (vysoká koncentrácia kyslíka).
Môže vám slúžiť: inulín: štruktúra, vlastnosti, jedlo, kontraindikácieU niektorých druhov patogénnych baktérií fungujú enzýmy SOD ako „virulenčné faktory“, ktoré im umožňujú prekonať mnoho oxidačných stresových bariér, ktorým môžu čeliť počas procesu invázie.
Súvisiace choroby
Zníženie aktivity superoxidu dysmutázy môže byť podané niekoľkými faktormi, vnútornými aj vonkajšími faktormi. Niektoré súvisia s priamymi genetickými defektmi v kódujúcich génoch pre enzýmy SOD, zatiaľ čo iné môžu byť nepriame, súvisiace s expresiou regulačných molekúl.
Veľký počet patologických stavov ľudských bytostí súvisí s enzýmami SOD vrátane obezity, cukrovky, rakoviny a iných.
Pokiaľ ide o rakovinu, bolo stanovené, že existuje veľké množstvo typov nádorov rakoviny, ktoré majú nízku hladinu ktoréhokoľvek z troch superoxidu cicavcov (SOD1, SOD2 a SOD3).
Oxidačný stres, že aktivita superoxidu dismutázy zabraňuje. Mnohé z týchto chorôb súvisia s expresiou faktorov, ktoré inhibujú aktivitu SOD, ako je napríklad faktor TNF-a.
Odkazy
- Fridovich, i. (1973). Swiden dysmuta. Anu. Otáčať sa. Biochem., 44, 147-159.
- Johnson, f., & Giulivi, C. (2005). Dysmutes superoxidu a vplyv IM na ľudské zdravie. Aspekty molekulárnej medicíny, 26, 340-352.
- Oberley, L. W., & Bueftner, G. R. (1979). Úloha superoxidu distínu v rakovine: prehľad. Výskum rakoviny, 39, 1141-1149.
- Taylor, P., Bowler, C., Tábor, w. Van, Montagu, m. Van, Inzé, D., & Pražené, k. (2012). Superoxid rozpadnutý v rastlinách. Kritické recenzie v vedách rastlín, 13(3), 37-41.
- Zelko, i., Mariani, T., & Folz, R. (2002). Superoxid Distam Multigén rodina: v porovnaní s génovými štruktúrami a expresiou CUZN (SOD1), MN-SOD (SOD2) a EC-SOD (SOD3), evolúcia a expresia. Voľné radikálne biológia a medicína, 33(3), 337-349.
- « Charakteristiky oligosacharidov, zloženie, funkcie, typy
- José Rubén Romero Životopis, štýl, diela »

