Štruktúra sulfidu vápenatého (CAS), vlastnosti, získanie, použitia
- 2879
- 22
- Valentín Dula
On Sulfid vápenatý Je to anorganická tuhá látka tvorená prvkom vápnika (CA) a prvkom sírou, chemického vzorca je CAS. Je to žltkastá biela rozpustná pevná látka vo vode, ktorá sa nachádza v prírode v niektorých sopkách a v niektorých meteoritoch vo forme minerálu zvanom Oldhamite.
CAS, keď sa rozpúšťajú vo vode2- stáva sa ión sh- a OH ióny sa vytvárajú-. Výsledný roztok je alkalický. Táto zlúčenina sa používa ako základ pre luminiscenčné zlúčeniny alebo ktoré za určitých podmienok produkujú viditeľné svetlo. Tieto materiály sa používajú aj v ľahkých obrazoch.
 CAS sulfid vápenatý sa našiel v niektorých meteoritoch. Autor: рote жравёё. Zdroj: Pixabay.
CAS sulfid vápenatý sa našiel v niektorých meteoritoch. Autor: рote жравёё. Zdroj: Pixabay. CAS sa považuje za možnú medicínu na liečbu srdcových problémov a krvných ciev, ako je hypertenzia alebo vysoký tlak, čo je choroba, ktorá ovplyvňuje veľkú časť svetovej populácie.
S sulfidom vápenatého je možné získať ďalšie zlúčeniny, ako je dusičnan vápenatý a uhličitan vápenatý. Musí sa s ňou zaobchádzať opatrne a v kontakte s vlhkosťou atmosféry môže produkovať h2S, ktorý je veľmi toxický.
[TOC]
Štruktúra
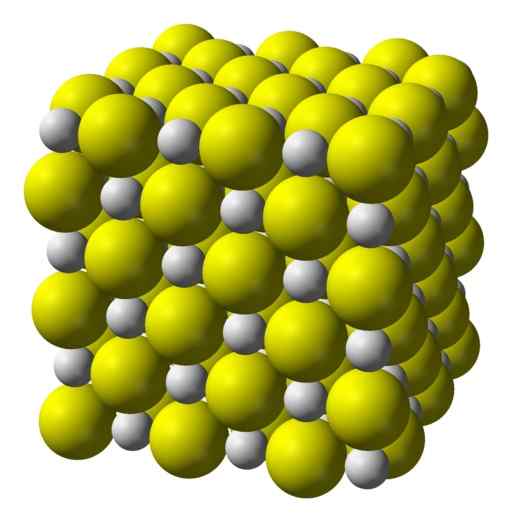
Sulfid vápenatý je vysoko iónová zlúčenina tvorená CA vápnikovým iónom2+ a sulfidové ióny s2-.
Kryštalizovať v kubickej štruktúre, ako je skalná soľ.
 Kubická kryštalická štruktúra sulfidu vápenatého. Žltá = síra; Biely. Benjah-Bmm27 / verejná doména. Zdroj: Wikimedia Commons.
Kubická kryštalická štruktúra sulfidu vápenatého. Žltá = síra; Biely. Benjah-Bmm27 / verejná doména. Zdroj: Wikimedia Commons. Menovanie
- Sulfid vápenatý
Fyzikálne vlastnosti
Fyzický stav
Žltkastá biela kryštalická pevná látka, kubické kryštály, ako je chlorid sodný.
Molekulová hmotnosť
72 144 g/mol
Bod topenia
2528 ° C
Hustota
2,59 g/cm3
Rozpustnosť
Rozpustný vo vode. Nerozpustný v etanole.
Chemické vlastnosti
Vodný roztok
Pri rozpustení vo vode sa CAS rozdelí na svoje ióny vápenatých 2+ a sulfid s2-. Ten vo vode berie protón a stáva sa hydrosulfúrovým iónom SHH- uvoľnenie hydroxylového iónu OH-.
Môže vám slúžiť: Preosejte saSiež2- + H2Alebo ⇔ sh- + Oh-
Preto sú roztoky sulfidu vápenatého alkalické (majú základné pH) a nemajú S ióny2- ale sh-.
Iba v prípade, že sa do roztoku, ako je hydroxid sodný NaOH, pridá veľké množstvo alkali2-.
 Sulfid vápenatý sa rozpúšťa vo vode tvoriacich iné zlúčeniny. Autor: Clker-Free-Vector-Images. Zdroj: Pixabay.
Sulfid vápenatý sa rozpúšťa vo vode tvoriacich iné zlúčeniny. Autor: Clker-Free-Vector-Images. Zdroj: Pixabay. Sh- Môžete si vziať ďalší protón h+ vody, tvoriace sulfid vodíka, čo je veľmi toxická zlúčenina.
Sh- + H2Alebo ⇔ h2S + oh-
Preto malé množstvá H sa tvoria vo vode2S a tým, že sú vystavené vlhkosti životného prostredia, CAS vydáva nepríjemný zápach typický pre síry vodíka.
Zlúčeniny prítomné pri rozpúšťaní vo vode
Výsledkom predtým naznačených reakcií na vodu je, že sa tvorí CA (SH)2, CA (OH)2 a ca (sh) (OH).
CAS + H2O → CA (SH) (OH)
CA (SH) (OH) + H2O → CA (OH)2 + H2Siež
Kyslá reakcia
Rovnaké reakcie, ktoré sa vyskytujú vo vode, spôsobujú, že CAS reaguje s kyselinami tvoriacimi h2Siež.
CAS + 2 HCI → CACL2 + H2Siež
Ďalšie reakcie
Ak je roztok sulfidu vápenatého so síry zahrievaný, získajú sa polysulfidové ióny42- a s32-.
Ak sa CAS zahrieva v suchom vzduchu alebo čistom kyslíku, zlúčenina sa oxiduje do puzdra sulfitu vápenatého3 A potom do prípadu síranu vápenatého4:
2 CAS + 3 o2 → 2 prípad3
2 puzdro3 + Ani2 → 2 prípad4
S oxidačnými činidlami, ako je chlorečník draselný KCLO3, Dusičnan draselný3 alebo oxid oxid2 Vyskytujú sa násilné reakcie.
Získanie
Sulfid vápenatý sa môže pripraviť kalcináciou (zahrievanie pri veľmi vysokej teplote) vápnika (CA) a síry (S) v inertnej atmosfére, to znamená, že nie sú prítomné napríklad kyslíkom alebo vodnou parou.
Môže vám slúžiť: kyselina chlór (HCLO2)CA + S + Teplo → CAS
Možno tiež získať zahrievaním puzdra sulfátu vápenatého4 S uhlím:
Prípad4 + 2 C → CAS + 2 CO2
V druhom prípade sa však nezíska čistý dom, pretože s týmto prípadom reaguje navyše4 formovanie CAO a tak2.
CAS sa tiež vytvára spaľovaním uhlia odpadu.
Prítomnosť v prírode
CAS je prirodzene prítomný v Oldhamitskom mineráli. Toto je súčasť niektorých meteoritov a je dôležitý pre vedecký výskum, ktorý sa vykonáva na slnečnej sústave.
Predpokladá sa, že Oldhamita bola tvorená kondenzáciou v hmlovine, ktorá vznikla v slnečnej sústave. Je tiež prítomný v sopkách.
 Sulfid CAS vápenatého je v Oldhamite Mineral, ktorý sa našiel v niektorých meteoritoch. Leon Hupperichs/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.
Sulfid CAS vápenatého je v Oldhamite Mineral, ktorý sa našiel v niektorých meteoritoch. Leon Hupperichs/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons. Okrem toho sa sulfid vápenatý prirodzene vyrába znížením prípadu4 (omietka) pravdepodobne pôsobením baktérií.
Žiadosti
V ľahkých materiáloch
Jeden z najrozšírenejších použití sulfidu vápenatého bol základom pre svetelné zlúčeniny. Toto sú látky, ktoré za určitých okolností vyžarujú viditeľné svetlo.
V luminiscenčných zlúčeninách CAS to pôsobí ako základňa a aktivátory sa pridávajú k štruktúre, ako sú chloridy určitých prvkov, ako je CERIO (CE3+) a Europio (EÚ2+).
Materiál vyplývajúci z únie CAS a aktivátor sa používa napríklad na obrazovkách katódových lúčov, ktoré tvoria staré obrazovky počítačov alebo počítačov alebo starých televíznych zariadení.
 Monitory starovekých počítačov mali katódové trubice, v ktorých sa niekedy niekedy používajú luminiscenčné zlúčeniny sulfidu vápenatého a aktivátorov. Autor: Andreas160578. Zdroj: Pixabay.
Monitory starovekých počítačov mali katódové trubice, v ktorých sa niekedy niekedy používajú luminiscenčné zlúčeniny sulfidu vápenatého a aktivátorov. Autor: Andreas160578. Zdroj: Pixabay. Používajú sa tiež v súčasných žiarovkách diód emitujúce svetlo alebo LED (skratka pre angličtinu Osvetľovacie diódy).
Môže vám slúžiť: ayaroína LED žiarovka. Niektoré môžu obsahovať luminiscenčné zlúčeniny sulfidu vápenatého. Nie je k dispozícii žiadny strojovo čitateľný autor. Apper predpokladal (na základe nárokov na autorské práva). /Cc By-SA (http: // creativeCommons.Org/licencie/By-SA/3.0/). Zdroj: Wikimedia Commons.
LED žiarovka. Niektoré môžu obsahovať luminiscenčné zlúčeniny sulfidu vápenatého. Nie je k dispozícii žiadny strojovo čitateľný autor. Apper predpokladal (na základe nárokov na autorské práva). /Cc By-SA (http: // creativeCommons.Org/licencie/By-SA/3.0/). Zdroj: Wikimedia Commons. Tieto materiály sa používajú aj vo svetelných maľbách a lakoch.
V medicíne
Sulfid vápenatý sa v lekárskych štúdiách považoval za liek na liečbu arteriálnej hypertenzie (vysoký tlak v tepnách). Toto je ochorenie, ktoré ovplyvňuje kardiovaskulárny systém mnohých ľudí (srdcové a krvné cievy).
CAS sa považuje za „darca“ H2Siež. To hrá dôležitú úlohu pri regulácii tónu alebo sily krvných ciev, takže podávanie CAS by mohlo byť možným liekom na liečbu hypertenzie.
 Sulfid vápenatý bol študovaný ako možný liek na vysoký tlak kardiovaskulárneho systému chorých ľudí. Autor: Mohamed Hassan. Zdroj: Pixabay.
Sulfid vápenatý bol študovaný ako možný liek na vysoký tlak kardiovaskulárneho systému chorých ľudí. Autor: Mohamed Hassan. Zdroj: Pixabay. Pri získavaní iných zlúčenín
Sulfid vápenatý umožňuje pripraviť ďalšie zlúčeniny, ako je dusičnan vápenatý CA (NO3)2:
CAS + 2 HNO3 → CA (nie3)2 + H2Siež
Používa sa tiež na získanie uhličitanu vápenatého Caco3. Z tohto2:
CAS + H2Alebo + co2 → H2S + Caco3
Ostatné aplikácie
Sulfid vápenatý sa tiež používa ako prísadka pre mazivá a ako flotačné činidlo pri extrakcii minerálov.
Riziká
Sulfid vápenatý môže spôsobiť podráždenie pokožky, očí a dýchacích ciest. Musí sa manipulovať s preventívnym opatrením a správnymi bezpečnostnými náradím.
Je to veľmi toxická zlúčenina pre vodný život, takže je pre tieto prostredia nebezpečná.
Odkazy
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Olovo, D.R. (editor). (2005). Príručka chémie a fyziky CRC. 85th CRC Press.
- Ropp, r.C. (2013). Skupina 16 (O, S, SE, TE) Zlúčeniny alkalických zemín. Sulfidový vápnik. V encyklopédii alkalických Zemech Zeme. Zotavené z vedeckých pracovníkov.com.
- Li, a.F. a kol. (2009). Sulfid vápenatý (CAS), darcovi sulfidu vodíka (H (2) S): Nový antihypertenzívny dragug? Med Hypothes, 2009 sep; 73 (3): 445-7. NCBI sa zotavila.NLM.NIH.Vláda.
- Dom j.A. a dom, k.Do. (2016). Síra, selén a telurium. Vyskytuje sa v síre. V deskriptívnej anorganickej chémii (tretie vydanie). Zotavené z vedeckých pracovníkov.com.
- Alebo.Siež. Lekárska knižnica. (2019). Sulfid vápenatý. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Pivo, m. a kol. (2014). Konverzia sulfidu vápenatého na uhličitan vápenatý počas procesu zotavenia elementárnej síry z odpadu zo sadry. Waste Manage, 2014 Nov; 34 (11): 2373-81. NCBI sa zotavila.NLM.NIH.Vláda.
- « Kvantitatívne výskumné charakteristiky, techniky, príklady
- Vlastnosti kremičitanu vápenatého, štruktúra, získanie, použitie, použitie »

