Štruktúra sulfidu hliníka (AL2S3), vlastnosti, použitie
- 4661
- 497
- Alfréd Blaho
On Sulfid hliníka (2Siež3) Je to svetlo šedá chemická zlúčenina tvorená oxidáciou kovového hliníka pri strate elektrónov z poslednej úrovne energie a stáva sa katiónom a redukciou nemetalickej síry, získaním elektrónov prenášaných hliníkom a stáva sa aniónom.
Aby sa to stalo a hliník môže poskytnúť svoje elektróny, je potrebné, aby ste predložili tri hybridné orbitály SP3, ktoré poskytujú možnosť formovania prepojení na elektróny zo síry.
Citlivosť sulfidu sulfidu z vody naznačuje, že v prítomnosti vodnej pary nájdenej vo vzduchu môže reagovať hydroxid hlinitý (AL (OH)3), sulfid vodíka (H2S) a vodík (h2) plynový; Ak sa tieto akumuluje, môže to spôsobiť výbuch. Preto by sa balenie sulfidu hliníka malo robiť pomocou hermetických nádob.
Na druhej strane, pretože sulfid hliníka má reaktivitu s vodou, je z neho prvok, ktorý nemá rozpúšťadlo rozpúšťadla.
Chemická štruktúra
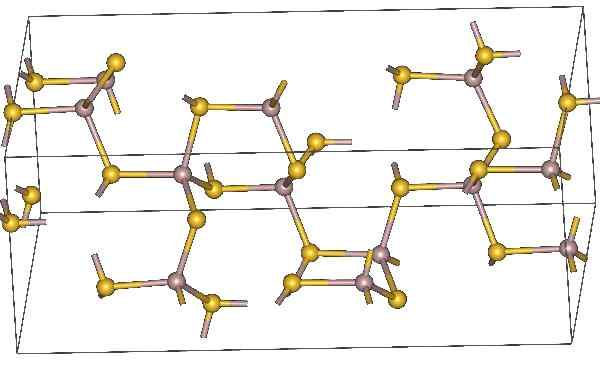
 Chemická štruktúra sulfidu hliníka. Žlté atómy predstavujú síru. Zdroj: Materialscientist, CC BY-SA 3.0, cez Wikimedia Commons
Chemická štruktúra sulfidu hliníka. Žlté atómy predstavujú síru. Zdroj: Materialscientist, CC BY-SA 3.0, cez Wikimedia Commons Molekulárna receptúra
Do2Siež3
Konštrukcia
 Menovanie
Menovanie
- Sulfid hliníka.
- Trisulfid di hliníka.
- Sulfid z hliníka (III).
- Sulfid hliníka.
Vlastnosti sulfidu hliníka
 Vzhľad sulfidu hliníka
Vzhľad sulfidu hliníka Chemické zlúčeniny väčšinou vykazujú dva druhy vlastností: fyzikálny a chemický.
Fyzikálne vlastnosti
Molárna hmota
150,158 g/mol
Hustota
2,02 g/ml
Bod topenia
1100 ° C
Rozpustnosť
Nerozpustný
Chemické vlastnosti
Jednou z hlavných reakcií sulfidu hliníka je voda, ako je substrát alebo hlavná reaktívna:

V tejto reakcii je možné pozorovať tvorbu hydroxidu hlinitého a sulfidu vodíka, ak je vo forme plynu alebo kyseliny sulfidu, ak sa rozpustí vo vode vo forme roztoku. Jeho prítomnosť je identifikovaná vôňou zhnitých vajíčok.
Môže vám slúžiť: chemické roztokyPoužitia a aplikácie
V Super CardPisors
Sulfid z hliníka sa používa pri výrobe štruktúr nano sietí, ktoré zlepšujú špecifickú povrchovú plochu a elektrickú vodivosť, takže je možné dosiahnuť vysokú kapacitu a hustotu energie, ktorej použiteľnosť je príprava supercaugádov.
Oxid grafénu (GO) - Grafén je jednou z alotropných foriem uhlíka - slúžil ako podpora sulfidu hlinitého (AL2Siež3) S hierarchickou morfológiou podobnou morfológii Nanorambután vyrobenej pomocou hydrotermálnej metódy.
Pôsobenie oxidu grafénu
Charakteristiky oxidu grafénu ako podpory, ako aj vysoká elektrická vodivosť a povrchová plocha, spôsobujú nanorambután2Siež3 byť elektrochemicky aktívny.
Špecifické krivky kapacity CV s dobre definovanými redoxnými vrcholmi potvrdzujú pseudokapacitné správanie nanorambutánu2Siež3 hierarchické, utrpené v oxidu grafénu v elektrolyte NaOH 1M. Konkrétne hodnoty kapacity CV získané z kriviek sú: 168,97 pri rýchlosti prieskumu 5 mV/s.
Okrem toho bol pozorovaný dobrý čas galvanostatického výboja 903 µs, čo je veľká špecifická kapacita 2178,16 k prúdu 3 mA/cm prúdu2. Hustota energie vypočítaná z galvanostatického výboja je 108,91 WH/kg, do prúdovej hustoty 3 mA/cm2.
Elektrochemická impedancia teda potvrdzuje pseudokapacitívnu povahu hierarchickej nanoratánovej elektródy2Siež3. Test stability elektród ukazuje 57,84 % retenciu špecifickej kapacity až 1 000 cyklov.
Experimentálne výsledky naznačujú, že nanorambután2Siež3 Hierarchické je vhodné pre aplikácie SuperCouding.
Môže vám slúžiť: chrómový hydroxid: štruktúra, vlastnosti, syntéza, použitieV sekundárnych lítiových batériách
S úmyslom vyvinúť sekundárnu lítiovú batériu s vysokou hustotou energie sa študoval sulfid hliníka (AL2Siež3) ako aktívny materiál.
Počiatočné opatrenie na stiahnutie2Siež3 Bolo to približne 1170 mAh g-1 až 100 m g-1. To zodpovedá 62 % teoretickej kapacity sulfidu.
Al2Siež3 Vykazoval zlú kapacitu v potenciálnom rozmedzí od 0,01 V do 2,0 V, najmä v dôsledku štrukturálnej nezvratnosti procesu zaťaženia alebo extrakcie Li.
Analýza XRD a K-XES pre hliník a síru naznačila, že povrch Al2Siež3 počas procesov načítania a vykladania reverzibilne reaguje, zatiaľ čo jadro Al2Siež3 Ukázal štrukturálnu nezvratnosť, pretože Lial a Li2S boli vytvorené z Al2Siež3 V počiatočnom sťahovaní a potom zostali tak, ako boli.
Riziká
- V kontakte s uvoľňovaním vody horľavé plyny, ktoré môžu spaľovať spontánne.
- Spôsobiť podráždenie kože.
- Spôsobiť vážne očné podráždenie.
- Môže spôsobiť podráždenie dýchacích ciest.
Informácie sa môžu líšiť medzi upozorneniami v závislosti od nečistôt, prísad a iných faktorov.
Postup prvej pomoci
Všeobecná liečba
Vyhľadajte lekársku starostlivosť, ak príznaky pretrvávajú.
Špeciálne zaobchádzanie
Žiadny
Dôležité príznaky
Žiadny
Vdýchnutie
Vezmite obeť vonku. Ak je dýchanie náročné, dodávajte kyslík.
Požitie
Spravujte jednu alebo dve poháre vody a vyvolajte zvracanie. Nikdy nevyvolajte zvracanie alebo nič v ústach nevedomému človeku.
Kožušina
Umyte postihnutú oblasť mäkkým mydlom a vodou. Odstráňte akékoľvek kontaminované oblečenie.
Oči
Umyte si oči vodou a bliká často niekoľko minút. Odstráňte kontaktné šošovky v prípade, že ich máte a naďalej opláchnite.
Môže vám slúžiť: Plavba pre tégliku: Charakteristiky, funkcie, použite príkladyProtipožiarne opatrenia
Ohavnosť
Nie horľavý.
Prostriedky vyhynutia
Reagovať vodou. Nepoužívajte vodu: Používajte hasiaci prístroj Co₂,, piesok a prach.
Bojový postup
Použite autonómne dýchacie prístroje s úplnou ochranou. Noste oblečenie, aby ste predišli kontaktu s pokožkou a očami.
Odkazy
- Zdravie a riziká.com, (s.f), definícia, koncepty a články o zdraví, rizikách a životnom prostredí. Získané: zdravie a riziká.com
- Sulfid hliníka. (s.F). Vo Wikiwand. Získané 9. marca 2018: Wikiwand.com
- Webové prvky.(s.F).Dialuminium Trisulpfide, získaný 10. marca 2018: WebElements.com
- LTS Research Laboratories, Inc (2016), Sulfid hliníkového hliníka: LTSCHEM.com

