Štruktúra pentahydrátu sulfátu meďnatého, použitie, použitie

- 2346
- 364
- Gabriel Bahna
On Sulfát medi Je to anorganická zlúčenina tvorená meďou (Cu), síry (S), kyslík (O) a voda (H2Buď). Obsahuje medené ióny (II) (Cu2+) a sulfát (tak42-). Jeho chemický vzorec je cuso4 •5H2Ani.
V prírode tvorí chalcantitu alebo kalkantný minerál, tiež nazývaný chalclasa alebo calclasa. Je to modrá kryštalická tuhá látka.
 Medený sulfát sulfátu meďnatého4 •5H2Ani. Autor: überraschungsbilder. Zdroj: Wikimedia Commons.
Medený sulfát sulfátu meďnatého4 •5H2Ani. Autor: überraschungsbilder. Zdroj: Wikimedia Commons. Používa sa ako výživový doplnok s niektorými zvieratami, ako sú prežúvatelia, ošípané a hydina. V poľnohospodárstve slúži ako pesticíd. V banských činnostiach umožňuje obnoviť ďalšie kovy.
Pre svoj modrý odtieň slúži na sfarbenie textílií a kovov. Používa sa na ukladanie kovovej medi na celulózové vlákna na získanie vodivých tkanín elektriny. Používa sa tiež na prípravu nanočastíc medi a jej oxidov s rôznymi aplikáciami.
Vo vysokých koncentráciách môže byť toxická pre faunu a flóru, takže sa niekedy používa na odstránenie škodcov (zvieratá alebo rastliny) vodných prostredí, ako sú lagúny a prírodné rybníky.
[TOC]
Štruktúra
Táto zlúčenina je tvorená medeným prvkom v jeho oxidačnom stave +2 a anión sulfátu. Ten má atóm síry s Valencia +6 obklopený štyrmi atómami kyslíka, každý s Valencia -2. Týmto spôsobom má sulfát ión dve negatívne náboje.
Má tiež 5 molekúl vody vo svojej štruktúre. Na nasledujúcom čísle môžete vidieť spôsob, akým sú usporiadané rôzne atómy v skle.
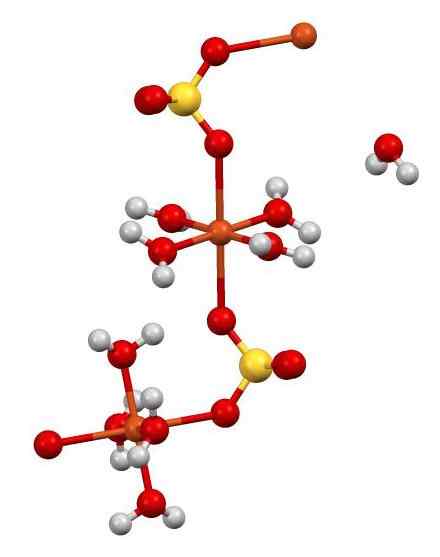 Cuo štruktúra4 •5H2Ani. Autor: Smokefoot. Zdroj: Wikimedia Commons.
Cuo štruktúra4 •5H2Ani. Autor: Smokefoot. Zdroj: Wikimedia Commons. Cu2+ (Oranžové gule) sú súčasne koordinované so 4 h molekulami2O (kyslík = červený; vodík = biely) a s 2 atómami kyslíka SOS42- (Síra = žltá). Na obrázku jedna z molekúl H2O Je to v zjavnej slobode, ale je súčasťou kryštalickej štruktúry.
Menovanie
 Minerál z Chalcantita Cuso4 •5H2Ani. Autor: Archaeodontosaurus. Zdroj: Wikimedia Commons.
Minerál z Chalcantita Cuso4 •5H2Ani. Autor: Archaeodontosaurus. Zdroj: Wikimedia Commons. - Sulfát medi
- Utrpenie medi (ii) pentahydrát
- Bluajack
- Modrý kameň (angličtina Modrý kameň)
- Chalcantita, Calcantita, Chalclasa alebo Calclasa
Vlastnosti
Fyzický stav
Modrá kryštalická tuhá látka.
Molekulová hmotnosť
249 686 g/mol
Bod topenia
Po dosiahnutí 110 ° C sa rozpadá.
Hustota
2 286 g/cm3
Rozpustnosť
Vodné rozpustné: 22,0 g/100 g vody pri 25 ° C. Metanol rozpustný (vyberte3Oh). Mierne rozpustný v etanole (vyberte3Chvály2Oh).
Chemické vlastnosti
Táto zlúčenina pri príchode do kontaktu s vodou sa rozpustí a vytvára ióny cu2+ A tak42-. Jeho rozpustnosť vo vode významne klesá, ak je kyselina sírová prítomná vo vode.
Môže vám slúžiť: Kampatý alkohol: štruktúra, receptúra, vlastnosti a použitiaH2SW4 Poskytuje ióny42- A jeho prítomnosť vytvára účinok „bežného iónu“, pretože tento ión je prítomný v pentahydrátovom sulfáne medi. Rozpustenie možno vyjadriť takto:
Cuso4 •5H2Alebo (pevná) + voda ⇔ cu2+ + SW42- + vodná voda
Preto, ak je to už prítomné v riešení42- kyseliny sírovej, rovnováha sa pohybuje doľava, to znamená smerom k tvorbe tuhej látky, a tak sa rozpustnosť znižuje.
Získanie
Jedným zo spôsobov, ako získať pentahydrát síran meďnatého, je rozpustenie malachitového minerálu vo vodnom roztoku kyseliny sírovej (H2SW4) pri regulovanej teplote. Malquita obsahuje Cu2(Oh)2Co3 S inými nečistotami, ako je železo.
Imbulný roztok medi (II) je ošetrený peroxidom vodíka (H2Ani2) zabezpečiť, aby nečistoty železa (ii) (viera2+) Staňte sa železom (iii) (viera3+). Ten sa vyrába vo forme hydroxidu železitého (viera (OH)3) pomocou hydroxidu sodného (NaOH).
Zrazenina znamená, že v roztoku sa tvoria častice nerozpustnej tuhej látky, ktorá padá na spodok nádoby, ktorá ju obsahuje.
 Vzhľad koncentrovaného roztoku CUSO4 •5H2Ani. Autor: verejné domény. Zdroj: Pixabay.
Vzhľad koncentrovaného roztoku CUSO4 •5H2Ani. Autor: verejné domény. Zdroj: Pixabay. Výsledná zmes sa filtruje, aby sa odstránila pevná látka viery (OH)3 A zostávajúca kvapalina je ošetrená etanolom (C2H5Oh), metanol (vyberte3OH) alebo kyselina sírová na zrážanie všetkých iónov cu2+ cuo4 •5H2Ani.
Pri pridávaní napríklad etanolu je pre Cu ióny k dispozícii menej vody2+ A tak42- sú v roztoku a majú tendenciu spájať sa. Pôsobí ako dehydratácia. Čím viac etanolu sa pridáva pevnejšie.
Zrážaná tuhá látka sa môže rekrimovať, aby sa jej očistila. Za týmto účelom sa rozpustí vo vode pri teplote 80-90 ° C a potom sa roztok ochladí pri 25-30 ° C. Pentahydrátová zlúčenina sa znova ponáhľa a nečistoty zostávajú v roztoku.
Žiadosti
Má široký interval komerčných aplikácií.
V oblasti poľnohospodárstva slúži ako pesticíd, insekticíd, herbicíd, fungicíd, germicid a prídavná pôda. Vo veterinárnych terapiách sa používa ako antihelmintický, fungicíd a emético (na zvracanie).
Používa sa ako modrý alebo zelený pigment vo farbeniach a farbivoch, ako mordant vo farbe tkanín a kovov. Tiež ako toner dojem na fotografiách a ako činidlo na zintenzívnenie negatívov.
Môže vám slúžiť: Efektívne jadrové zaťaženiePoužíva sa v banských aktivitách ako flotačné činidlo na zotavenie zinku a olova. Slúži na výrobu iných medených zlúčenín, používa sa v opáleniu.
V potravinách pre zvieratá
Táto zlúčenina sa používa v strave ošípaných vo veľmi malom množstve ako promótor rastu, najmä v zadnej fáze. Mechanizmus, ktorým má tento účinok, je stále známy.
Niektorí vedci tvrdia, že znižuje populáciu patogénnych alebo škodlivých baktérií v čreve zvierat a následne uprednostňuje ich rast.
 S cusom4 •5H2O môžete uprednostňovať vývoj odstavených ošípaných. Autor: Mabelamber. Zdroj: Pixabay.
S cusom4 •5H2O môžete uprednostňovať vývoj odstavených ošípaných. Autor: Mabelamber. Zdroj: Pixabay. Iní vedci naznačujú, že zlepšuje zdravie čreva týchto zvierat, ale určité vyšetrenia naznačujú, že intravenózna injekcia meďnatého tiež zlepšuje jej rast.
Používa sa tiež na rovnaký účel v hydine a používa sa v nedostatku meďnatého prežúvavcov.
V syntéze nanočastíc
Na získanie zmiešaných nanočastíc medi a oxidu medi (I) (Cu/Cu sa použil síran meďnatého2Buď).
Nanočastice sú extrémne malé štruktúry, ktoré je možné vidieť iba prostredníctvom elektronického mikroskopu.
Cu/cu prach2O Vo forme nanočastíc, ktorý používa pri katalýze alebo zrýchlení chemických reakcií, v polovodičoch a v antimikrobiálnych materiáloch,.
V štúdiách na kontrolu škodcov
Cuso4 •5H2Alebo sa používa v skúsenostiach na vyhodnotenie jeho toxicity voči slimákom druhu Pomacea canaliculata.
Jedná sa o pôvodné mäkkýše tropických oblastí Južnej Ameriky, ktoré obývajú rôzne typy ekosystémov, od močiarov a lagún po jazerá a rieky.
Sú študované, pretože niektorí hostiteľskí ľudskí paraziti, ako napríklad Schistosoma Mansoni (trematód, ktorý vyvoláva chorobu Bilharzie). Caracoles môžu byť tiež škodlivé pre poľnohospodárske plodiny zaplavených regiónov.
 Caparazones de los Caracoles Pomacea canaliculata. H. Zell/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.
Caparazones de los Caracoles Pomacea canaliculata. H. Zell/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.  Vajcia uložené slimákmi vo vodnej rastline. Tieto slimáky niekedy tvoria mor, ktorý je možné ovládať pomocou cuso4 •5H2Ani. Shan LV, Národný inštitút parazitických chorôb/CC od (https: // creativecommons.Org/licencie/BY/2.5). Zdroj: Wikimedia Commons.
Vajcia uložené slimákmi vo vodnej rastline. Tieto slimáky niekedy tvoria mor, ktorý je možné ovládať pomocou cuso4 •5H2Ani. Shan LV, Národný inštitút parazitických chorôb/CC od (https: // creativecommons.Org/licencie/BY/2.5). Zdroj: Wikimedia Commons. Podľa preskúmaných štúdií sú roztoky sulfátu medi s vodnou pentahydrátom pre tieto slimáky mimoriadne toxické, takže táto zlúčenina sa môže použiť na odstránenie mäkkýšov z zamorených oblastí.
Môže vám slúžiť: spaľovacie reakciePodľa určitých vyšetrovaní je to preto, že slimák nepotrebuje medený ión, takže iba kontakt s týmto iónom by stačil na to, aby sa smrť zvieraťa vyskytla.
V vodivých tkaninách elektriny
Táto zlúčenina sa použila pri získavaní textilných materiálov s integrovanými elektrickými senzormi. Tento typ tkaniny má aplikáciu v zariadeniach na skladovanie elektrickej energie, tlakových senzorov, fotodetektor a obrazovky emitujúce svetlo.
Na získanie vodivých tkanín elektriny je kovové vlákno tkanej celulózovej celulózy nazývané „Lyocell“ pokryté kovovou meďou. Poter sa vykonáva neelektrolytickým spôsobom na základe roztoku CUSO4 • 5H2O a ďalších pomocných chemických zlúčenín.
 Vlákno. Tento typ tkaniny sa použil v testoch na poťahovanie medi. Dobrozhinetsky/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.
Vlákno. Tento typ tkaniny sa použil v testoch na poťahovanie medi. Dobrozhinetsky/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons. Tkanina získaná týmto spôsobom môže preniesť elektrický signál aj za podmienok deformácie alebo napínania udržiavajúce vysokú vodivosť.
Účinky na životné prostredie
Ako je vysvetlené vyššie ako cuso4 •5H2Alebo pri rozpustení vo vode generuje ión medi (II).
Aj keď meď je nevyhnutná v nízkych koncentráciách bunkových aktivít živých organizmov, môže byť vo vysokých koncentráciách toxická a dokonca spôsobiť smrť.
Preto prítomnosť tohto iónu v prostredí predstavuje riziko pre zvieratá a rastliny. Vo vodných ekosystémoch môže byť bioakumulácia v živých bytostiach a v potravinovom reťazci, čo spôsobuje poškodenie.
 Cuso4 •5H2O môže to byť škodlivé pre vodné prostredie. Autor: Jamesdemers. Zdroj: Pixabay.
Cuso4 •5H2O môže to byť škodlivé pre vodné prostredie. Autor: Jamesdemers. Zdroj: Pixabay. V skutočnosti sa v určitých skúsenostiach zistilo, že kontaminácia vodných prostredí s pentahydrátovým síranom medi spôsobuje, že biomasa určitých vodných rastlín klesá.
Čo znamená, že rastliny rastú menej v prítomnosti tejto soli vo vysokých koncentráciách.
Odkazy
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- Kokes, h. a kol. (2014). Rozpustenie medi a železa z malachitovej rudy a presnosť pentahydrátu sulfátu medi chemickým procesom. Engineering Science and Technology, medzinárodný denník. 2014; 17 (1): 39-44. Zotavené z vedeckých pracovníkov.com.
- Azevedo B Alves., J.P. a peixoto, m.N. (2015). Znižovanie biomasy Otravná salvinia Vystavený pentahydrátu sulfátu medi (CUO4.5H2Buď). Otáčať sa. Okolitý. Water 2015; 10 (3): 520-529. Zotavené z Doaj.orgán.
- Koreň, w. a kol. (2019). Flexibilný textilný snímač kmeňa založený na celulózovej tkanine typu Lyocell potiahnutého medi. Polymers 2019, 11, 784. MDPI sa zotavila.com.
- Pitelli, r.Do. a kol. (2008). Akútna toxicita síranu meďnatého a vodného extraktu zo sušených listov neem na slimáky (Pomacea canaliculata). Akt. Biol. Sci. 2008; 30 (2): 179-184. Zotavené z Doaj.orgán.
- Badawy, s.M. a kol. (2015). Syntéza, charakterizácia a katalytická aktivita nanočastíc Cu/Cu2O pripravených vo vodnom médiu. Bulletin chemického reakčného inžinierstva a katalýzy. 2015; 10 (2): 169-174. Zotavené z Doaj.orgán.
- Justel, f.J. et al (2014). Rozpolie a fyzikálne vlastnosti nasýtených roztokov v sírane medi + kyselina sírová + systém morskej vody pri rôznych teplotách. Brazílsky denník chemického inžinierstva. 2015; 32 (3): 629-635. Zotavené z Doaj.orgán.
- Park, C.Siež. a Kim, b.G. (2016). In vitro Rozpustnosť trikxidu sulfátu meďnatého (II) a dikopper chloridu pre ošípané. Ázijské Austalas. J. Ani. Sci. 2016; 29 (11): 1608-1615. Zotavené z Doaj.orgán.
- Alebo.Siež. Lekárska knižnica. (2019). Pentahydrát sulfátu medi. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Wikipedia (2020). Chalcanthit. Získaný z.Wikipedia.orgán.
- « Charakteristiky morských biomas, typy, flóra, fauna
- Štruktúra voskov (biologická), vlastnosti, funkcia, typy »

