Síran amónny
- 789
- 115
- Alan Milota
Vysvetlíme, čo je síran amónny, jeho chemická štruktúra, fyzikálne a chemické vlastnosti a používa
Čo je síran amónny?
On síran amónny Je to ternárna a amoniaková anorganická soľ kyseliny sírovej. Jeho chemický vzorec je (NH4)2SW4. Preto stechiometrické rozmery hovoria, že pre každý sulfátový anión s ním interagujú dva katióny amónnych. To umožňuje neutralitu soli ((+1) ∙ 2 + (-2)).
Jeho nomenklatúra je spôsobená skutočnosťou, že je soľ odvodená od H2SW4, Zmena prípony „močovej“ pre „ATO“. Preto sú dva počiatočné protóny nahradené NH4+, produkt reakcie s amoniakom (NH3). Chemická rovnica pre svoju syntézu je: 2 NH3 + H2SW4 => (NH4)2SW4
Síran amónny sa tiež pripravuje reakciou uhličitanu amónneho s sulfátom vápenatého: (NH4)2Co3 + Prípad4 => (NH4)2SW4 + Zlodej3, Vyrážanie uhličitanu kalika, ktorý je oddelený od zostávajúcej kvapaliny.
Síran amónny je skladovanie dusíka a síry, ktoré je nevyhnutné v chémii pôdy a hnojivách.
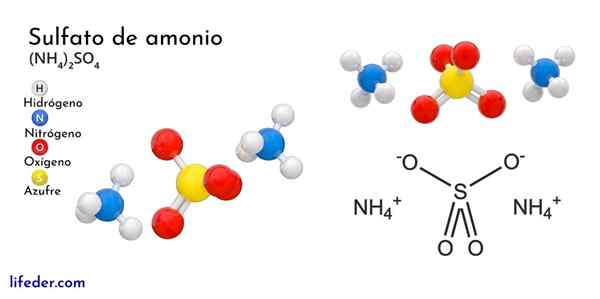
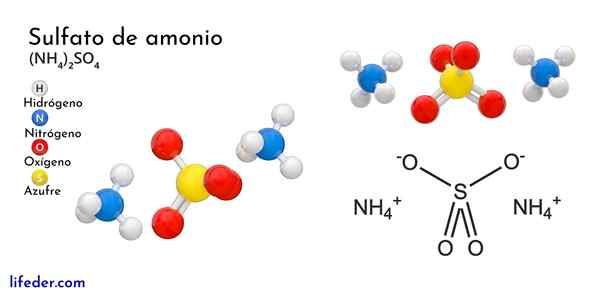
Chemická štruktúra síranu amónneho

Vynikajúci obraz ilustruje molekulárne geometrie iónov NH4+ A tak42-. Červené gule zodpovedajú atómom kyslíka, atómami bielych až vodíka, atóm modrého až dusíka a žltý atóm síry.
Oba ióny sa môžu považovať za dve tetraedru, a tak majú tri jednotky, ktoré interagujú za tvorbu orlombického kryštalického usporiadania. Anión síranu je taký42- A je schopný darovať alebo akceptovať štyri vodíkové mosty, ako aj NH katión4+.
Vlastnosti síranu amónneho
Molekulová hmotnosť
132,134 g/mol.
Môže vám slúžiť: Vzťah chémie a technológie s človekom, zdravím a životným prostredímFyzický vzhľad
Biela pevná látka. Biele alebo hnedé orrhrombické kryštály, v závislosti od úrovne nečistôt.
Vôňa
Záchod.
Bod topenia
280 ° C. Tento bod topenia, pod ostatnými iónovými zlúčeninami, je preto, že je to soľ s monovalentnými katiónmi (+1) a so maskovanými iónmi vo svojich veľkostiach, čo spôsobuje, že pevná látka má nízku kryštalickú retikulárnu energiu.
Rozpustnosť
76,4 g/100 g vody pri 25 ° C. Táto afinita k vode je spôsobená veľkou kapacitou ich molekúl vyriešiť ióny amónnych. Na druhej strane je nerozpustný v acetóne a alkoholu; to znamená, v menej polárnych rozpúšťadlách ako voda.
Hustota
1,77 g/cm3 pri 25 ° C.
Tlak vodnej pary
1 871 kPa pri 20 ° C.
Bod vzplanutia
26 ° C.
pH
5,0 - 6,0 (25 ° C. Riešenie 1 m). Mierne kyslé pH je spôsobené hydrolýzou NH4+ Vo vode, produkuje H3Ani+ pri nízkych koncentráciách.
Stabilita
Stabilný v primeraných podmienkach prostredia. V kontakte so silnými oxidantmi môže zapáliť oheň.
Rozklad
Začína sa rozkladať pri 150 ° C a uvoľňuje výpary oxidu toxického síry, oxid dusíka a amónny.
Korózia
Neútočí železo alebo hliník.
Použitie síranu amónneho
V poľnohospodárstve
- Amónny síran sa používa ako hnojivo v alkalických pôdach. Amónna soľ má vo svojom zložení 21 % dusíka a 24 % síry. Existujú však zlúčeniny, ktoré poskytujú množstvo dusíka väčšie ako síran amónny; Výhodou tohto je vysoká koncentrácia síry.
- Síra je nevyhnutná pri syntéze proteínov, pretože niekoľko aminokyselín - napríklad cystín, metionín a cysteín - má síru. Z týchto dôvodov je síran amónny naďalej jedným z najdôležitejších hnojív.
- Používa sa na pšenicu, kukuricu, ryžu, bavlnu, zemiaky, konope a ovocné plodiny.
- PH alkalických pôd dole pre ich príspevok v procese nitrifikácie vykonávaného mikróbmi. Používa sa amónny (NH4+) na výrobu dusičnanu (nie3-) a uvoľnite h+: 2nh4+ + 42 => 2NO3- + 2h2O + 4H+. Zvýšenie koncentrácie vodíka znižuje pH alkalických pôd a umožňuje väčšie použitie.
- Okrem použitia ako hnojiva pôsobí síran amónny ako adjuvans rozpustných insekticídov, herbicídov a fungicídov, ktoré sa postriekajú na plodiny.
- Sulfát je schopný únosu iónov prítomných v pôde a zavlažovacej vode, ktoré sú potrebné pre životy určitých patogénov. Medzi ióny, ktoré zachytávajú síran amónny, patrí CA2+, Mg2+, vernosť2+ A viera3+. Táto akcia zvyšuje mikrobicídny účinok vyššie uvedených látok.
Ako analytické činidlo
Síran amónny pôsobí ako zrážajúce činidlo pri elektrochemickej analýze, uprostred mikrobiologickej kultúry a pri príprave amónnych solí.
Pri zrážaní a izolácii proteínov
Síran amónny sa používa na izoláciu a čistenie proteínov, najmä v plazme. Do plazmy sa pridá množstvo síranu amónneho, aby sa dostal do určitej koncentrácie; Zrážanie proteínovej skupiny je teda spôsobené.
Zráža sa zrazenina centrifugáciou a supernatant sa pridá ďalšie množstvo síranu amónneho a k novej koncentrácii sa vytvorí zrážky inej skupiny proteínu.
Opakovanie predchádzajúceho procesu postupne umožňuje získanie rôznych frakcií plazmatických proteínov.
Predtým, ako sa objavia nové technológie molekulárnej biológie, tento postup umožnil izoláciu plazmatických proteínov, ktoré majú veľký význam v medicíne, napríklad: imunoglobulíny, koagulačné faktory atď.
V priemysle
Síran amónny pôsobí oneskorením začiatku požiaru v textilnom priemysle. Používa sa ako prísada v priemysle elektroenchapado. Používa sa tiež pri výrobe peroxidu vodíka, chloridu amónneho atď.
Iné použitia
- Síran amónny sa používa ako regulačné činidlo osmotického tlaku a ako zrážajúce sa činidlo solí.
- Vo forme laurilu síranu amónneho znižuje povrchové napätie vody, čo umožňuje oddelenie znečisťujúcich látok zvýšením tvrdosti vody.
- Je antikorózne činidlo.
- Používa sa ako potravinová prísadňa, ktorá reguluje kyslosť v múkovom cesto a chlebe.
- « Koncept misie a osobnej vízie, ako ich robiť, príklady
- Neskoršie soli Čo sú, nomenklatúra, vlastnosti, príklady »