Sulfát z hliníka (AL2 (SO4) 3)

- 2525
- 655
- Mgr. Pravoslav Mokroš
 Kryštály sulfátu bieleho hliníka
Kryštály sulfátu bieleho hliníka Čo je síran hliník?
On síran hliník Je to anorganická vzorec hliníková soľ na2(SW4)3, ktoré sa zvyčajne vyskytujú ako biela tuhá látka lesklých kryštálov. Farba zlúčeniny bude ovplyvnená jej koncentráciou železa a akoukoľvek inou nečistotou. Existujú dva hlavné typy síranu hliníka: A a B.
Je to veľmi rozpustná soľná soľ av prírode je zriedkavé nájsť ju vo svojej bezvodej forme. Zvyčajne sa hydratuje v tvare síranu hliníka octadecahydrátu [do2(SW4)3.18H2Alebo] alebo hexadecahydrát [až2(SW4)3.16h2Buď].
Môže tiež tvoriť dvojité soli s draslíkom a s amónnym, zlúčeniny známe ako svetlá. Čiastočne to môže byť spôsobené afinitou vody vo vnútri hydrátov na udržanie iných iónov, okrem hliníka.
Chemická štruktúra síranu hliníka
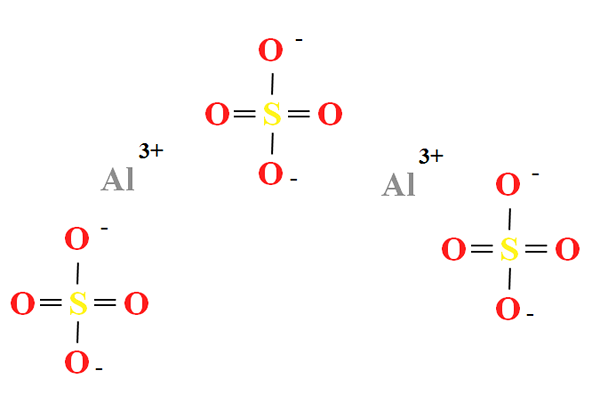 Chemická štruktúra síranu hliníka. Zdroj: Gabriel Bolívar
Chemická štruktúra síranu hliníka. Zdroj: Gabriel Bolívar Hliníkový síran má podiel dvoch katiónov k3+ za každé tri anióny42- (vynikajúci obraz), ktorý je možné pozorovať priamo vo svojom chemickom receptúre k2(SW4)3.
Poznač si to3+ Sú sivé, zatiaľ čo SOS42- Sú žlté (pre atóm síry) a červené (atómami kyslíka).
Ilustrovaná štruktúra zodpovedá bezvodej forme Al2(SW4)3, Pretože žiadna molekula vody interaguje s iónmi. Vo svojich hydrátoch však môže voda priťahovať k pozitívnym centrám Al3+, alebo pre negatívnu tetraedru tak42- pomocou vodíkových mostov (hah-o-tak32-).
Al2(SW4)3∙ 18h2Alebo napríklad obsahuje 18 molekúl vody vo svojej pevnej štruktúre. Niektorí z nich môžu byť v priamom kontakte s ním3+ alebo so SOS42-. Inými slovami: síran hliník môže mať vnútornú alebo vonkajšiu koordinačnú vodu.
Jeho štruktúra môže tiež umiestniť ďalšie katióny, ako je viera3+, Nat+, Klimatizovať+, atď. Ale za to je potrebná prítomnosť viac pod aniónmi42-, na neutralizáciu zvýšenia pozitívneho zaťaženia v dôsledku nečistôt kovov.
Hliníkový síran môže mať veľa štruktúr, hoci jeho hydráty majú tendenciu prijímať monoklinický kryštalický systém.
Fyzikálne a chemické vlastnosti
Aspekt
Je prezentovaný ako tuhá látka s blikajúcimi bielymi kryštálmi, granulami alebo prachom.
Molekulová hmotnosť
342,31 g/mol (bezvodý).
Vôňa
Je to toaleta.
Príchuť
Sladká chuť, mierne astringent.
Bod topenia
770 ° C forma anhydra (86,5 ° C OctadeCahydrátovej formy).
Rozpustnosť
31,2 g/100 ml pri 0 ° C; 36,4 g/100 ml pri 20 ° C a 89 g/100 ml pri 100 ° C.
Hustota
2,67 až 2,71 g/cm3.
Rozpustnosť
Mierne rozpustný v etylalkoholu.
Tlak vodnej pary
V podstate nula.
Stabilita
Vo vzduchu.
Rozklad
Pri zahrievaní, približne do jeho bodu topenia, môže byť zlomený emitovaním najmä oxidu síry, toxický plyn.
Kričanie
Roztoky sulfátu z hliníka sú korozívne pre hliník. Zlúčenina môže tiež korodovať kovy v prítomnosti vlhkosti.
Môže vám slúžiť: glukoneogenézaPka
3,3 až 3,6. A jeho pH je 2,9 alebo viac vo vodnom roztoku na 5%.
Hliníkový síran sulfát
Koagulácia alebo flokulácia
- Pri zmiešaní s vodou (pitnými, podávanými alebo odpadom), síran hliník spôsobuje hydroxid hlinitý, ktorý tvorí komplex so zlúčeninami a časticami v roztoku zrýchlením jeho sedimentácie, ktorý by v neprítomnosti ošetrenia síranom hlinitého trval neskoro dlho dlho.
- Hliníkový síran sa používa aj na čistenie vody v bazéne, vďaka čomu je príťažlivejší na použitie.
- Prostredníctvom použitia síranu hliníka sa dosiahne voda bez zákalu a farby, čím sa zvyšuje jeho jednostranná situácia uľahčovaním čistenia vody. Bohužiaľ táto metóda čistenia môže viesť k mierne rozšírenej koncentrácii hliníka vo vode.
- Hliník je veľmi toxický kov, ktorý sa hromadí v koži, mozgu a pľúcach a spôsobuje vážne poruchy. Okrem toho nie je známe, čo funkcia plne v živých bytostiach plní.
- Európska únia vyžaduje, aby maximálny povolený limit hliníka vo vode nepresahoval 0,2 mg/l. Na druhej strane Agentúra pre ochranu životného prostredia USA vyžaduje, aby maximálny limit znečistenia vody s hliníkom nepresiahol 0,05-0,2 mg/l/l.
- Ošetrenie vody používaných alebo podávaných s hliníkovým síranom umožňuje ekonomicky elimináciu alebo zníženie fosforu.
Používam ako atramentový mordant a pri vypracovaní papiera
- Hliníkový síran sa používa ako mordant farbív alebo atramentov, čo pomáha pozerať sa na textilný materiál. Jeho fixačná akcia je spôsobená Al (OH)3, ktorého želatínska konzistencia spolupracuje s adsorpciou farbív na textil.
- Aj keď sa používa približne od roku 2000 do.C. S opísaným účelom vyžadujú iba organické farbivá. Na druhej strane syntetické farbivá nevyžadujú, aby sa Mordanty plnili svoju funkciu.
- Bol vysídlený z výroby papiera, ale stále sa používa pri vypracovaní papierovej buničiny. Odstráňte svoje nečistoty, ako aj na prepojenie materiálov, neutralizáciu zaťaženia a kalibráciu kolophónie.
Priemyselné použitie
- Používa sa v stavebnom priemysle na urýchlenie betónového prostredia. Okrem toho sa používa pri hydroizolácii konštrukcií.
- V priemysle mydiel a tukov sa používa pri výrobe glycerínu.
- V ropnom priemysle na vypracovanie syntetických katalyzátorov, ktoré používajú počas svojej prevádzky.
- Používa sa vo farmaceutickom priemysle ako astringent pri príprave drog a kozmetiky.
- Zasahuje do vypracovania farbív, ako je karmín. Používa sa tiež ako farbivo pri výrobe syntetického gumového buttadiene Stretus.
- V priemysle výroby cukru sa používa ako čistička melasy cukrovej trstiny.
- Používa sa pri výrobe dezodorantov, pretože spôsobuje zúženie potrubí potných žliaz, čím obmedzuje akumuláciu potu, čo je potrebné pre rast baktérií, ktoré spôsobujú zápach zápachu.
- Používa sa v opaľovaní kože, čo je proces potrebný na použitie. Okrem toho sa používa pri výrobe hnojív.
- Používa sa ako prísada pri vypracovaní obrazov, lepidiel a tesniacich látok, ako aj čistiacich a starostlivých výrobkov nábytku.
Liečivé a terapeutické použitie
- Sulfát z hliníka je imunitný adjuvant. Preto spĺňa funkciu spracovania antigénov takým spôsobom, že keď sa uvoľňujú v mieste pôsobenia, vytvárajú väčšiu produkciu protilátok pre antigény, ktoré boli naočkované.
- Freund a BCG adjuvant, ako aj ostatné adjuvanty, vrátane endogénov, ako sú interleukíny, sú nešpecifické pre antigény, čo umožňuje zvýšenie polomeru imunitného pôsobenia. To umožnilo vypracovanie vakcín proti mnohým chorobám.
- Koagulantný účinok síranu hliníka umožnil okrem iného elimináciu mnohých vírusov v ošetrenej vode, ako je beta, ms2, t4 a p1. Výsledky naznačujú, že ošetrenie vody síranom z hliníka vyvoláva inaktiváciu takýchto vírusov.
- Hliníkový síran sa používa v bare alebo ako prach pri liečbe malých povrchových rán alebo odrevení produkovaných holením.
- Používa sa na výrobu hliníkového octanu, zlúčeniny používanej pri liečbe niektorých ušných podmienok. Používa sa tiež bez významného úspechu na zmiernenie dôsledkov uhryznutia mravcov.
- Roztoky síranu z hliníka sa používajú pri koncentrácii 5% až 10%, pri lokálnom zaobchádzaní s vredmi, ktoré umožňujú kontrolu nad ich sekréciami.
- Astringentný účinok síranu hlinitého sťahuje povrchové vrstvy kože, koagulačné proteíny a hojené rany.
Iné použitia
- Hliníkový síran pomáha pri kontrole nadmerného rastu rias v rybníkoch, jazerách a vodných prúdoch. Používa sa tiež pri odstraňovaní mäkkýšov, medzi nimi španielsky slimák.
- Záhradníci aplikujú túto zlúčeninu na okyslenie alkalických pôd. V kontakte s ich vodou sa hliník sulfát rozkladá v hydroxidu hlinitého a zriedenej kyseliny sírovej. Potom sa zráža hydroxid hlinitý, zostávajúca kyselina sírová.
- Okyslenie pôdy v dôsledku kyseliny sírovej sa vizualizuje veľmi kreatívnym spôsobom v dôsledku existencie rastliny nazývanej hortenzia, ktorej kvety sa v prítomnosti kyslej pôdy stávajú modrou; to znamená, že sú citliví a reagujú na zmeny pH.
- Hliníkový síran zasahuje do vypracovania peny na boj proti ohňu: reaguje s hydrogenuhličitantom sodným a vytvára uvoľňovanie CO2. Tento plyn blokuje prístup k O2 do miesta spaľovania materiálu a následne zastavenia požiaru, ktorý sa vyvinul.
Výroba síranu hliníka
Hliníkový síran sa syntetizuje reakciou zlúčeniny bohatej na hliník, ako je bauxitový minerál, s kyselinou sírovou pri vysokých teplotách. Reakcia predstavuje nasledujúca chemická rovnica:
Do2Ani3 + H2SW4 -> Al2(SW4)3 + 3 h2Ani
Hliníkový síran sa môže tiež tvoriť prostredníctvom neutralizačnej reakcie medzi hydroxidom hlinitého a kyselinou sírovou podľa nasledujúcej reakcie:
2 až (oh)3 + 3 h2SW4 + 12 h2Alebo -> do2(SW4)3.18H2Ani
Kyselina sírová reaguje s hliníkom za vzniku síranu amónneho a uvoľňovanie molekúl vodíka vo forme plynu. Reakcia je schematizovaná takto:
2 až +3 h2SW4 -> Al2(SW4)3 + 3 h2
Typy síranu hliníka
Hliníkový síran je klasifikovaný do dvoch typov: typ A a typ B. V hliníkovom sírane typu sú tuhé látky biele a majú koncentráciu železa menšie ako 0,5%.
U síranu hliníka typu B sú pevné látky hnedé a majú koncentráciu železa menšie ako 1,5%.
Existujú odvetvia výroby síranu hliníka, ktoré majú rôzne kritériá pre klasifikáciu. Odvetvie sa teda podáva správy o príprave typu síranu hlinitého na maximálnu koncentráciu 0,1% železa ako oxid železitý.
Zatiaľ čo pre typ B označujú maximálnu koncentráciu železa 0,35%.
Toxicita síranu hliníka
- Hliníkový síran je zlúčenina, ktorá vyvíja jeho toxický pôsobenie kontaktom s prachom, čím spôsobuje podráždenie kože, av prípadoch, keď je kontakt častý, dermatitída.
- V očiach spôsobuje silné podráždenie, dokonca spôsobuje trvalé zranenia.
- Jeho vdýchnutie spôsobuje podráždenie nosa a hrdla, ktorý môže spôsobiť kašeľ a Carraspera.
- Jeho príjem spôsobuje podráždenie žalúdka, nevoľnosť a zvracanie.
- Existujú toxické účinky, že hoci nie sú spôsobené priamo sulfátom z hliníka, sú nepriamo na ich použitie. Toto je prípad určitých toxických účinkov hliníka, spôsobené použitím síranu hlinitého pri čistení vody.
- Pacienti, ktorí sú chronicky diagizovaní pomocou soli pripravených v purifikovanej vode pomocou síranu hlinitého, majú veľmi závažné poruchy zdravia. Medzi týmito poruchami spomíname anémia, dialýzu demencie a zvýšenie kostných chorôb.
Odkazy
- Wikipedia. (2018). Síran hliník. Prevzaté z: v.Wikipedia.orgán
- Priemyselný. Hliníkový síran typu A a B. Prevzaté: Aris.com.pešo
- Christopher Boyd. (9. júna 2014). Najlepšie priemyselné použitia síranu hliníka. Prevzaté z: chemservice.com
- Publikácia. (2018). Bezvodý hliníkový. Zobraté z: pubchem.Ncbi.NLM.NIH.Vláda
- Chemická andézia. (20. augusta 2009). Hliníkový sulfát bezpečnostný list. [PDF]. Prevzaté z: Andézia.com
- Chemická kniha. (2017). Síran hliník. Zobraté z: Chemicalbook.com

