Roztoky tlmiča

- 1121
- 0
- MUDr. Žigmund Boška
Vysvetľujeme, aké sú tlmené riešenia, ich vlastnosti, komponenty, typy a uvádzame niekoľko príkladov
 Roztoky absorbujúce nárazy regulujú pH okolo špecifickej hodnoty
Roztoky absorbujúce nárazy regulujú pH okolo špecifickej hodnoty Čo sú tlmené riešenia?
Ten roztoky tlmiča, Nazývajú sa aj tlmivé roztoky, regulátory pH alebo tlmivých roztokov, sú vodné roztoky tvorené slabinou kyselinou a jej konjugátovou bázou alebo slabým základom a jej konjugovanou kyselinou.
Nazývajú sa roztoky tlmiča, pretože majú schopnosť tlmiť zmenu pH po pridaní kyselín alebo báz v malom množstve, aj keď sú to silné kyseliny alebo základne.
Roztoky tlmiča sú veľmi užitočné, pretože umožňujú konštantu pH. Existuje veľa chemických reakcií, ktoré potrebujú špecifické a konštantné pH, aby fungovali dobre.
Vlastnosti riešení Morpaineary
Sú to vodné roztoky
Koncept pH aj stupnica pH majú zmysel iba vo vodných roztokoch, takže všetky tlmivé roztoky alebo tlmené roztoky sa pripravujú vo vode.
Jeho prevádzka je založená na rovnováhe s kyslou základňou a princípmi Le Chatlierer
Tuffire sú založené na reverzibilných reakciách disociácie kyseliny/bázy, ktoré sú v rovnováhe. Pridaním silných kyselín alebo základní do životného prostredia je táto rovnováha narušená, takže systém reaguje na boj proti narušeniu podľa zásad Le Catelier. Takto sa vyrovnávacie pamäte podarí tlmiť veľké zmeny v pH.
Vaše pH sa ľahko vypočíta s Henderson-Haselbalchovou rovnicou
Bez ohľadu na to, aký typ roztoku tlmiča, jeho pH pred a po pridaní malých množstiev silných kyselín alebo báz, je možné ho vypočítať pomocou Henderson-Hohaselbalchovej rovnice:
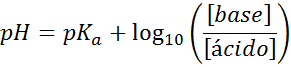
Kde [báza] sa vzťahuje na molárnu koncentráciu bázy (alebo soľ konjugátovej bázy) a [kyselina] sa týka molárnej koncentrácie kyseliny (alebo soli konjugovanej kyseliny).
Môže vám slúžiť: elastické materiálySú schopní čiastočne neutralizovať kyseliny aj základne
Roztoky tlmenia sú tvorené základnou látkou a kyslou látkou, ktorá dokáže neutralizovať bázy a kyseliny. Z tohto dôvodu môžu po pridaní silných kyselín a silných základní tlmiť pH pH.
Jeho prevádzka závisí od teploty
PH roztoku pufra závisí od kyslosti alebo základnej konštanty kyseliny alebo slabej bázy, ktorú obsahuje. Táto konštanta závisí od teploty, takže prevádzka týchto roztokov tiež závisí od teploty.
Čím viac koncentrovanejšia, tým väčšia je jeho schopnosť odpružiť alebo regulovať pH
Tlžovacia kapacita závisí od celkovej koncentrácie roztoku je väčšia ako konečná koncentrácia kyseliny alebo silnej bázy, ktorá sa pridáva. Z tohto dôvodu, čím väčšia je celková koncentrácia roztoku pufra, tým väčšia je jeho schopnosť tlmiť kyseliny alebo silné základne.
Komponenty tlmenia alebo roztoku vyrovnávacej pamäte
Chemicky sa tlmiace roztoky tvoria iba dvoma komponentmi. Tieto komponenty môžu byť slabá kyselina zmiešaná so soľou z jej konjugátovej bázy alebo slabá báza zmiešaná so soľou jej konjugovanej kyseliny.
Existujú dva rôzne spôsoby, ako získať tieto komponenty v rovnakom riešení, ako uvidíme nižšie:
1. Príprava vyrovnávacích pamätí miešajú roztoky svojich komponentov
Toto je najpriamejší spôsob prípravy riešenia vyrovnávacej pamäte. Za týmto účelom sa pripravujú samostatné roztoky samostatné roztoky slabej kyseliny (napríklad kyselina octová) a konjugátová báza (napríklad octatá sodný)). Potom sa obe roztoky postupne miešajú až do požadovaného pH.
Môže vám slúžiť: iónový amónny (NH4+): vzorec, vlastnosti a použitia
- Roztoky sú zmiešané tak málo až do požadovaného pH
2. Príprava tlmivých roztokov čiastočnou neutralizáciou roztoku slabej kyseliny
V tomto prípade sa s požadovanou celkovou koncentráciou pripravuje slabý kyslý roztok a potom sa hydroxid sodný alebo draselný pridá len málo, až kým nedosiahne požadované pH.
Typy nárazníkových riešení
Roztoky tlmiča šokov možno klasifikovať podľa typov komponentov, ktoré majú, alebo podľa ich konečného pH.
Podľa typov komponentov:
- Slabá a konjugovaná základná vyrovnávacia pamäť: V týchto prípadoch pH závisí od PKdo slabá kyselina.
- Slabý bázický pufr a konjugovaná kyselina: V týchto prípadoch závisí pH od PKb slabý.
- Túffer polyprotických kyselín: V niektorých prípadoch sú úloha slabej kyseliny a jej konjugátovej bázy solí z čiastočnej neutralizácie kyseliny, ktorá má niekoľko protónov, ako je kyselina sírová alebo fosforka.
Podľa jeho konečného pH:
V závislosti od kyslosti alebo základnej konštanty môže roztok pufra regulovať pH okolo rôznych rozsahov pH, čo vedie k trom typom vyrovnávacích pamätí:
- Kyslé tlmivé roztoky: Sú tie, ktoré regulujú pH okolo hodnôt nižší ako 7. Sú pripravené so slabými kyselinami, ktorých PKdo byť menej ako 7 alebo so slabými základňami, ktorých PKb byť väčší ako 7.
- Neutrálne pufry: Sú tie, ktoré regulujú pH okolo 7. Zvyčajne sa skladajú zo slabých kyselín alebo základní, ktoré majú PKdo alebo PKb takmer 7.
- Alkalické vyrovnávacie pamäte: Sú tie, ktoré regulujú pH okolo hodnôt viac ako 7. Sú pripravené so slabými kyselinami, ktorých PKdo byť väčší ako 7 alebo so slabými základňami, ktorých PKb je menej ako 7.
Príklady vyrovnávacích pamätí alebo tlmených roztokov
Kyselina kyselina octa/octan sodný
Jedná sa o pufer slabej kyseliny (kyselina octová) a soľ jej konjugátovej bázy (octat sodný). Zahrnutá rovnováha a jej rovnovážna konštanta sú:
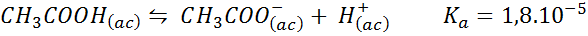
Tento tlmivý roztok reguluje pH v okolí 4.74.
Amoniakový tlmivý roztok/chlorid amónny
Jedná sa o slabý bázický tlmivý roztok (amoniak alebo hydroxid amónny) a soľ jej konjugovanej kyseliny (chlorid amónneho). Zahrnutá rovnováha a jej rovnovážna konštanta sú:
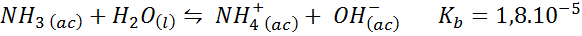
Toto je alkalický tlmivý roztok, ktorý reguluje pH v okolí 9.26.
Vyrovnávanie bisulfátu/sulfátu
V tomto prípade bisulfátový ión hrá papier slabej kyseliny, ktorej konjugátovou základňou je sulfát ión. Zostatok je:
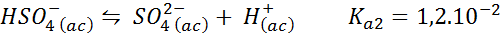
Jedná sa o kyslý roztok, ktorý reguluje pH okolo 3,05.
Kyselina uhličitá/hydrogenuhličitan pufri
Toto je jeden z najdôležitejších regulačných systémov pH v našej krvi. Reakcia je: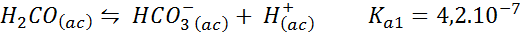
Tento tlmivý roztok reguluje pH v okolí 6.38.
Dihydrogén pufrový fosfát/fosfát vodíka
Toto je jeden z najpoužívanejších regulačných systémov pH v biológii a biochémii, pretože umožňuje regulovať pH veľmi blízko k fyziologickému pH, ku ktorému dochádza väčšina chemických reakcií v bunkách. Reakcia je:
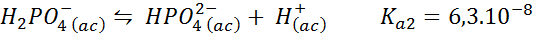
Tento tlmivý roztok reguluje pH v okolí 7.20.

