Komponenty izotonického roztoku, príprava, príklady
- 5002
- 649
- Tomáš Mydlo
A izotonické riešenie Je to ten, ktorý predstavuje rovnakú koncentráciu rozpustenej látky vzhľadom na roztok oddelený alebo izolovaný semiperpermosable Bug. Táto bariéra umožňuje rozpúšťadlu prepisovať, ale nie všetky častice rozpustených látok.
Vo fyziológii sa tento izolovaný roztok vzťahuje na intracelulárnu tekutinu, to znamená vnútro buniek; Zatiaľ čo semipermosabilná bariéra zodpovedá bunkovej membráne, tvorená lipidnou dvojvrstvou.
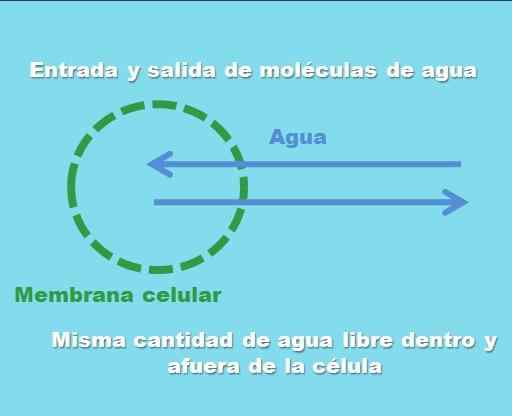
 Interakcia bunky s izotonickým roztokom. Zdroj: Gabriel Bolívar.
Interakcia bunky s izotonickým roztokom. Zdroj: Gabriel Bolívar. Vynikajúci obrázok ilustruje, čo sa myslí izotonickým riešením. „Koncentrácia“ vody je rovnaká vo vnútri a mimo bunky, takže ich molekuly vstupujú alebo vyjdú cez bunkovú membránu s rovnakými frekvenciami. Preto, ak do bunky vstupujú dve molekuly vody, dve z nich budú súčasne opustiť extracelulárne médium.
Tento stav, nazývaný izotonicita, sa uskutočňuje iba vtedy, keď vodné médium, vo vnútri a mimo bunky, obsahuje rovnaký počet rozpustených častíc rozpustenej látky. Roztok bude teda izotonický, ak je koncentrácia jeho rozpustených látok podobná koncentrácii tekutiny alebo intracelulárneho média. Napríklad 0,9% roztok soľného roztoku je izotonický.
[TOC]
Komponenty izotonických riešení
Aby existoval izotonické riešenie, musí najprv zabezpečiť, aby sa osmóza vyskytla v roztoku alebo rozpúšťadle. To je možné iba vtedy, ak je prítomná semipermaktívna bariéra, ktorá umožňuje molekulám rozpúšťadla ich prenášať, ale nie z rozpustených látok, najmä elektricky naložených rozpustených látok, iónov.
Rozpustenie sa teda nemôže šíriť z koncentrovanejších oblastí do zriedenejších oblastí. Namiesto toho to budú molekuly vody, ktoré sa presunú z jedného miesta na druhé, prekročia semipermosabilnú bariéru a uskutoční sa osmóza. Vo vodných a biologických systémoch je táto bariéra par excellence bunková membrána.
Môže vám slúžiť: Konkurencia (biológia): Charakteristiky, typy, príkladyPri semiperpermistickej bariére a rozpúšťadlovom médiu je tiež potrebná prítomnosť rozpustených iónov alebo solí v oboch médiách: vnútorná (vo vnútri bariéry) a vonkajšia (mimo bariéry).
Ak je koncentrácia týchto iónov rovnaká na obidvoch stranách, nebude existovať prebytok alebo deficit molekúl vody na ich vyriešenie. To znamená, že počet molekúl bez vody je rovnaký, a preto neprenesie semiperpermosent Barrier kdekoľvek s účelom porovnávania koncentrácií iónov.
Príprava
- Podmienky a rovnica
Aj keď izotonický roztok sa dá pripraviť s akýmkoľvek rozpúšťadlom, pretože voda je médiom buniek, považuje sa to za obľúbenú možnosť. Presne poznať koncentráciu solí v špecifickom tele tela alebo v krvnom obehu je možné odhadnúť, koľko solí sa musí rozpustiť v danom objeme.
V organizmoch stavovcov sa uznáva, že v priemere je koncentrácia rozpustených látok v krvnej plazme okolo 300 mosm/l (Miliosmolarita), ktorá je schopná interpretovať takmer ako 300 mmol/l. To znamená, že je to veľmi zriedená koncentrácia. Na odhad Miliosmolarity sa musí uplatniť nasledujúca rovnica:
Osmolarita = m · v · g
Na praktické účely sa predpokladá, že g, Osmotický koeficient má hodnotu 1. Takže rovnica je teraz ako:
Osmolarita = m · v
Kde m Je to molarita rozpustenej látky a vložka Počet častíc, v ktorých uvedená rozpustená látka disociuje vo vode. Potom túto hodnotu vynásobíme 1.000 na získanie miliosmolarity pre konkrétnu rozpustenú látku.
Môže vám slúžiť: Čo je homoplázia? (S príkladmi)Ak existuje viac ako jedna rozpustená látka, celková miliosolarita roztoku bude súčtom tisícovsmolarity pre každú rozpustenú látku. Čím viac rozpustenej látky vzhľadom na vnútro buniek, tým menej izotonikí bude pripravený roztok.
- Príklad prípravy
Predpokladajme, že chcete pripraviť liter izotonického roztoku založeného na glukóze a fosforečnanom sodnom a fosforečnanom sodnom. Koľko by malo vážiť glukózu? Predpokladajme, že sa použije 15 gramov NAH2Po4.
Prvý krok
Najprv musíme určiť osmolaritu NAH2Po4 Výpočet jeho molarity. Aby sme to dosiahli, obraciame sa na jeho molárnu hmotnosť alebo molekulovú hmotnosť, 120 g/mol. Pretože sme požiadaní o liter roztoku, určujeme móly a budeme mať priamo molaritu:
Móly (nie2Po4) = 15 g ÷ 120 g/mol
= 0,125 mol
M (nie2Po4) = 0,125 mol/l
Ale keď nie2Po4 Rozpúšťa sa vo vode, uvoľňuje katión+ a anión h2Po4-, preto vložka Má hodnotu 2 v rovnici osmolarity. Pokračujeme v výpočte pre NAH2Po4:
Osmolarita = m · v
= 0,125 mol/l · 2
= 0,25 osm/l
A jeho vynásobením 1.000 Máme miliosmolaritu NAH2Po4:
0,25 osm/l · 1.000 = 250 mosm/l
Druhý krok
Pretože celková miliosolarita roztoku sa musí rovnať 300 mosm/l, odpočítame, aby sme vedeli, aká by mala byť glukóza:
MOSM/L (glukóza) = MOSM/L (celkom) - MOSM/L (NAH2Po4)
= 300 mosm/l - 250 mosm/l
= 50 mosm/l
Pretože glukóza sa nerozlišuje, vložka Vale 1 a jeho osmolarita sa rovná jeho molarite:
M (glukóza) = 50 mosm/l ÷ 1.000
= 0,05 mol/l
Ako molár glukózy 180 g/mol, konečne určíme, koľko gramov musíme vážiť, aby sme ho rozpustili v tomto lite izotonického roztoku:
Môže vám slúžiť: Renina: Štruktúra, výroba, sekrécia, funkcieHmotnosť (glukóza) = 0,05 mol · 180 g/mol
= 9 g
Preto toto izotonické riešenie NAH2Po4/glukóza pripravuje 15 gramov NAH2Po4 a 9 gramov glukózy v liter vody.
Príklady izotonických riešení
Izotonické roztoky alebo kvapaliny nespôsobujú žiadne gradienty alebo zmenu v koncentrácii iónov v tele, takže ich činnosť sa v podstate zameriava na hydratačných pacientov, ktorí ho dostávajú v prípade krvácania alebo dehydratácie.
Normálny soľný roztok
Jedným z týchto roztokov je normálny soľný roztok s koncentráciou 0,9% NACL.
Roztok laktátu zvonenia
Ďalšie izotonické roztoky používané na rovnaký účel sú roztoky Laktátu Ringer, ktorý znižuje kyslosť v dôsledku jeho pufra alebo tlmenia, a Sorensenove fosfátové roztoky, ktoré sa skladajú z fosfátov a chloridu sodného.
Necelálne systémy
Izotonickosť sa môže použiť aj na nevodné systémy, ako sú systémy, v ktorých je rozpúšťadlo alkohol; Pokiaľ existuje semipermostná bariéra, ktorá uprednostňuje priehľadnosť molekúl alkoholu a zachováva častice rozpustených látok.
Odkazy
- Od Lehr Spilva, do. A muktans a. (1999). Sprievodca farmaceutickými špecialitami vo Venezuele. Vydanie xxxvª. Globálne vydania.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Elsevier B.Vložka. (2020). Izotonické riešenie. Zdroj: ScienceDirect.com
- Adrienne Brundage. (2020). Izotonické riešenie: Definícia a príklad. Štúdium. Získané z: štúdie.com
- Felicitas Merino de la Hoz. (s.F.). Intravenózna séroterapia. University of Cantabria. [PDF]. Získané z: OCW.Jednoznačný.je
- Laboratórium farmaceutiky a zloženia. (2020). Oftalmické prípravky: izotonické vyrovnávacie pamäte. Obnovené z: Pharmlabs.Unc.Edu

