Nenasýtený roztok
- 1716
- 115
- Tomáš Mydlo
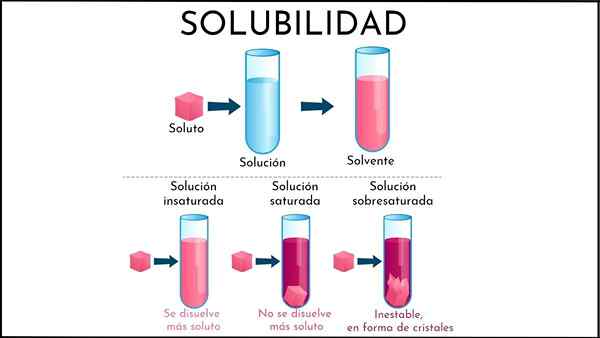
 V nenasýtenom roztoku je polovica rozpúšťadla stále schopná rozpustiť viac rozpustenej látky
V nenasýtenom roztoku je polovica rozpúšťadla stále schopná rozpustiť viac rozpustenej látky Čo je nenasýtené riešenie?
A nenasýtený roztok Je to všetko riešenie, v ktorom je rozpúšťadlo stále schopné rozpustiť viac rozpustenej látky. Toto médium je vo všeobecnosti tekuté, hoci môže byť tiež plynné. Pokiaľ ide o rozpustenú látku, ide o konglomerát tuhých alebo plynných častíc.
A čo tekuté rozpustene? V takom prípade je roztok homogénny, pokiaľ sú obe tekutiny miešateľné. Príkladom je pridanie etylalkoholu do vody; Dve kvapaliny s ich molekulami, cho3Chvály2Ach h2Alebo sú miešateľné, pretože tvoria mosty vodíka (vyberte si3Chvály2Oh2).
Ak sa však diklórmetán zmesi (vyberte si2Cl2) a voda by vytvorila roztok s dvoma fázami: jedna vodná a druhá organická. Je to preto, že choty chrámy2Cl2 a h2Alebo interagovať veľmi slabo, takže niektorí sa skĺznu nad ostatnými, čo vedie k dvom nemiešateľným tekutom.
Minimálny pokles Cho2Cl2 (rozpustená látka) dostatočne na nasýtenie vody (rozpúšťadlo). Ak by naopak mohli tvoriť nenasýtené roztok, bolo by vidieť úplne homogénne riešenie.
Z tohto dôvodu môžu iba pevné a plynné rozpustené látky generovať nenasýtené roztoky.
Čo je nenasýtené riešenie?
V nenasýtenom roztoku molekuly rozpúšťadla interagujú s účinnosťou tak, že molekuly rozpustených látok nemôžu tvoriť inú fázu.
To znamená, že interakcie rozpúšťadla-solute presahujú, vzhľadom na tlakové a teplotné podmienky, interakcie rozpustenej látky.
Akonáhle sa interakcie rozpustenej látky zvýšia, „zorganizujú“ tvorbu druhej fázy. Napríklad, ak je rozpúšťadlo médium kvapalina a rozpustená látka A tuhá látka, druhá sa rozpustí v prvom, aby vytvorila homogénny roztok, až kým sa neobjaví tuhá fáza, čo nie je nič viac ako zrážaná rozpustená látka.
Môže vám slúžiť: polymetylmetatakrylátTáto zrazenina je spôsobená skutočnosťou, že molekulám rozpustených látok dokážu byť zoskupené podľa ich chemickej povahy, vnútorné pre ich štruktúru alebo väzby. Keď sa to stane, hovorí sa, že roztok je nasýtený rozpustenou látkou.
Preto nenasýtený roztok rozpustenej látky pozostáva z kvapalnej fázy bez zrazeniny. Zatiaľ čo ak je rozpustená látka plynná, potom nenasýtené roztok musí byť bez prítomnosti bublín (ktoré nie sú ničím iným ako zhlukmi nealkoholických nápojov).
Teplotný efekt
Teplota priamo ovplyvňuje stupeň nenasýtenia roztoku vzhľadom na rozpustenú látku.
To môže byť hlavne z dvoch dôvodov: oslabenie interakcií rozpustenej látky v dôsledku tepelného účinku a zvýšenie molekulárnych vibrácií, ktoré pomáhajú rozptýliť molekuly rozpustených látok.
Ak sa rozpúšťadlo považuje za kompaktný priestor, v ktorom sú umiestnené molekuly rozpustených otvorov, teplota zvyšuje, že molekuly vibrujú zväčšujúcu sa veľkosť týchto otvorov; takým spôsobom, že rozpustená látka sa môže dostať v iných smeroch.
Nerozpustné tuhé látky
Niektoré rozpustené látky majú však také silné interakcie, že molekuly rozpúšťadla sú sotva schopné ich oddeliť.
Ak je to tak, minimálna koncentrácia uvedenej rozpustenej rozpustenej látky je dostatočná na to, aby sa zrazila, a potom je to nerozpustná tuhá látka.
Nerozpustné tuhé látky vytvorením druhej tuhej fázy, ktorá sa líši od kvapalnej fázy, vytvára málo nenasýtených roztokov.
Napríklad, ak 1 l kvapaliny A môže rozpustiť iba 1 g B bez zrážania, potom pri miešaní 1 l s 0.5 g B vygeneruje nenasýtené roztok.
Môže vám slúžiť: hydrokoloidPodobne aj hodnosť koncentrácií v rozmedzí od 0 do 1 g B vytvára nenasýtené roztoky. Ale po 1 g, B sa zráža. Ak k tomu dôjde, roztok prechádza z nenasýteného na nasýtenie z B.
Ak je nasýtený roztok s 1 predložený na zahrievanie.5 g B, teplo pomôže rozpustenie zrazeniny. Ak je však veľa zrážaných, teplo ho nemôže rozpustiť.
Ak áno, zvýšenie teploty by jednoducho vyparilo rozpúšťadlo alebo kvapalinu.
Príklady nenasýteného roztoku
Príklady nenasýtených roztokov sú početné, pretože závisia od rozpúšťadla a rozpustenej látky. Napríklad pre tú istú tekutinu A a ďalšie rozpustené látky C, D, E… Z, ich roztoky budú nenasýtené, pokiaľ nebudú zrážať alebo nevytvárať bublinu (ak sú plynné rozpustené látky).
-More môže prispieť dvoma príkladmi. Morská voda je obrovský záchranný roztok. Ak umiestnite trochu tejto vody, bude potrebné poznamenať, že je nenasýtená v neprítomnosti vyzrážanej soli. Avšak, ako sa voda odparuje, rozpustené ióny sa začínajú zoskupovať a soľný slany prilepia na hrniec.
-Ďalším príkladom je rozpustenie kyslíka v mori. Molekula O2 Frank Hĺbky mora dosť na to, aby dýchal morskú faunu, hoci je málo rozpustné.
Z tohto dôvodu je bežné pozorovať kyslíkové bubliny, ktoré sa objavujú na povrchu; z toho pár molekúl dokáže rozpustiť.
Podobná situácia sa vyskytuje pri molekule oxidu uhličitého, CO2. Na rozdiel od o2, CO2 Je o niečo rozpustnejší, pretože reaguje s vodou za vzniku kyseliny uhličitej, h2Co3.
Môže vám slúžiť: materiálne systémyRozdiel so nasýteným roztokom
Zhrnutie novo vysvetleného, aké sú rozdiely medzi nenasýteným a nasýteným roztokom? Po prvé, vizuálny aspekt: nenasýtené riešenie pozostáva z jednej fázy. Preto by nemala byť prítomnosť tuhej (tuhej fázy) alebo bubliny (fáza sódy).
Koncentrácie rozpustených látok v nenasýtenom roztoku sa môžu meniť, až kým sa nevytvorí zrazenina alebo bublina. Zatiaľ čo v nasýtených, bifázových roztokoch (kvapalné pevný alebo kvapalný), koncentrácia rozpustenej rozpustenej látky je konštantná.
Pretože? Pretože častice (molekuly alebo ióny), ktoré tvoria zrazeninu, stanovujú rovnováhu s tými, ktoré ležia v rozpúšťadle:
Častice zrazeného rozpustených častíc
Bublinové molekuly rozpustené molekuly
Tento scenár sa v nenasýtených riešeniach neuvažuje. Keď sa snaží rozpustiť viac rozpustenej látky v nasýtenom roztoku, rovnováha sa presunie doľava; k tvorbe viac zrazeniny alebo bublín.
Pretože v nenasýtených roztokoch táto rovnováha (saturácia) ešte nebola stanovená (saturácia) „uloží“ pevnejšie alebo plynové plyny.
Okolo rias v morskom dne je rozpustený kyslík, ale keď sa z jeho listov rodia kyslíkové bubliny, znamená to, že dochádza k nasýteniu plynu; Inak by sa bubliny nepozorovali.
Odkazy
- Všeobecná chémia. vyučovací materiál. Lima: Pontifická katolícka univerzita v Peru. Získané z: Korint.Pucp.Edu.pešo
- HelMestine, Anne Marie, PH.D. (2018). Definícia nenasýteného riešenia. Zotavené z: Thoughtco.com
- Tutorvista (s.F.). Nenasýtený roztok. Zobraté z: chémie.Lektorka.com
- Chémia librettexts (s.F.). Typy saturácie. Získané z: Chem.Librettexts.orgán
- Nadine James. (2018). Nenasýtené riešenie: Definícia a príklad. Získané z: štúdie.com

