Buteno

- 2717
- 305
- Ing. Ervín Petruška
 Chemická štruktúra buuténu
Chemická štruktúra buuténu Čo je Buteno?
On Buteno Je to názov, ktorý prijíma sériu štyroch izomérov s chemickým vzorcom C4H8. Sú to alkény alebo olefíny, to znamená, že majú vo svojej štruktúre dvojitú väzbu c = c. Okrem toho sú to uhľovodíky, ktoré sa nachádzajú v usadeninách oleja alebo vzniknuté tepelným krakovaním a získaním produktov s nižšou molekulovou hmotnosťou.
Štyri izoméry reagujú s kyslíkom uvoľňujúcim teplo a žltý plameň. Môžu tiež reagovať so širokým spektrom malých molekúl, ktoré sa pridávajú k ich dvojitej väzbe.
Ale aké sú izoméry buteno? Na hornom obrázku je štruktúra s bielymi guľami (hydrogény) a čiernymi (uhlíkom) znázornená pre 1-butén. 1-butén je najjednoduchší izomér uhľovodíka C4H8.
Všimnite si, že existuje osem bielych guľôčok a štyri čierne gule, ktoré súhlasia s chemickým vzorcom.
Ďalšie tri izoméry sú CIS a trans 2-butén a izo-butén. Všetky vykazujú veľmi podobné chemické vlastnosti, hoci ich štruktúry spôsobujú variácie fyzikálnych vlastností (body fúzie a varu, hustoty atď.).
Ich spektrá majú tiež podobné vzorce absorpčných pásov.
Collowily je 1-butén pomenovaný ako Buteno, hoci 1-butén sa vzťahuje iba na jediný izomér a nie na všeobecné meno. Tieto štyri organické zlúčeniny sú plyny, ale môžu byť skvapalnené do vysokých tlakov alebo kondenzovaných.
Sú zdrojom tepla a energie, činidiel pre syntézu iných organických zlúčenín a predovšetkým potrebné na výrobu umelej gumy po syntéze butadiénu.
Fyzikálne a chemické vlastnosti buteno
Molekulová hmotnosť
56.106 g/mol. Táto hmotnosť je rovnaká pre všetky izoméry vzorca C4H8.
Fyzické aspekty
Je to bezfarebný a horľavý plyn (ako ostatné izoméry) a majú relatívne aromatický zápach.
Bod varu
Body varu pre izoméry buteno sú nasledujúce:
1 -buténa: -6 ° C
Cis-2-butén: 3.7. c
Trans-2-butén: 0.96 ° C
2 -metylpropén: -6.9 ° C
Bod topenia
1 -buténa: -185.3. c
Cis-2-butén: -138.9 ° C
Trans-2-butén: -105.5. c
2 -metylpropeno: -140.4. c
Rozpustnosť
Buteno je veľmi nerozpustný vo vode kvôli svojej apolárnej povahe. Perfektne sa však rozpúšťa v niektorých alkoholoch, ako je benzén, toluén a étery.
Hustota
0.577 až 25 ° C. Preto je menej hustý ako voda a v nádobe, ktorá by sa nachádzala nad rovnakým.
Reaktivita
Rovnako ako každá alkén, aj jeho dvojitá väzba je náchylná na pridávanie molekúl alebo oxidácie. Vďaka tomu je buteno a jeho izoméry reaktívne. Na druhej strane sú to horľavé látky, takže pred prebytkom teploty reagujú s kyslíkom vzduchu.
Môže vám slúžiť: bután: Štruktúra, vlastnosti, použitia a rizikáChemická štruktúra buuténu
Na hornom obrázku je reprezentovaná štruktúra 1-buténu. Vľavo môžete vidieť umiestnenie dvojitého spojenia medzi prvým a druhým uhlíkom.
Molekula má lineárnu štruktúru, hoci oblasť okolo spojenia C = C je plochá v dôsledku hybridizácie SP2 z týchto uhlíkov.
Keby bola molekula 1-buténu otočená pod uhlom 180 °, rovnaká molekula by nemala zjavné zmeny, preto jej chýba optická aktivita.
Ako by vaše molekuly interagovali? Spojenia C-H, C a C-C sú apolárne povahy, takže žiadna z nich spolupracuje pri formovaní dipólového momentu.
V dôsledku toho molekuly Cho2= Chch2Chvály3 Musia interagovať prostredníctvom londýnskych disperzných síl.
Pravý koniec buténu tvorí okamžitý dipól, ktorý na krátku vzdialenosť polarizuje susedné atómy susednej molekuly. Na druhej strane ľavý koniec odkazu C = C, interaguje prekrývajúce sa oblaky π na druhej strane (napríklad dva doštičky alebo listy).
Pretože existujú štyri atómy uhlíka, ktoré tvoria molekulárnu kostru, jej interakcie sú dosť ťažko na to, aby kvapalná fáza mala bod varu -6 ° C.
Ústavné a geometrické izoméry
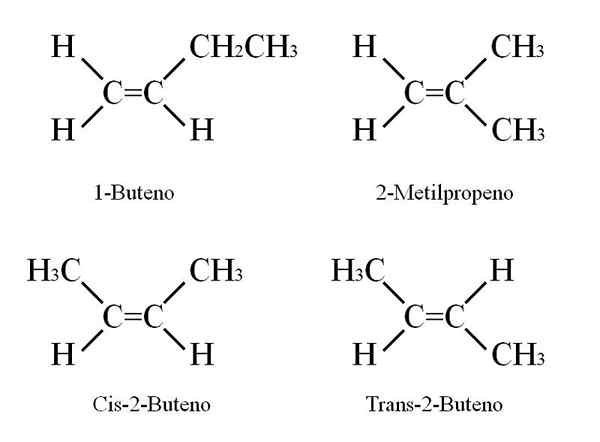 Butenózne štruktúry. Zdroj: Gabriel Bolívar
Butenózne štruktúry. Zdroj: Gabriel Bolívar 1-butén má molekulárny vzorec C4H8; Iné zlúčeniny však môžu mať vo svojej štruktúre rovnaký podiel atómov C a H.
Ako je to možné? Ak je štruktúra 1-buténu pozorne pozorovaná, môžu sa vymeniť substituenty uhlíkov C = C. Táto výmena vytvára ďalšie zlúčeniny z toho istého kostru.
Okrem toho sa dvojitá pozícia väzby medzi C-1 a C-2 môže pohybovať smerom k C-2 a C-3: CH3Chch3, 2-butén.
V 2-buténe môžu byť atómy H umiestnené na rovnakú stranu dvojitej väzby, ktorá zodpovedá stereoizoméru cis; alebo v opačnej priestorovej orientácii v transteroizoméri Trans. Obidve tvoria aj to, čo sa nazýva geometrické izoméry. To isté platí pre skupiny -ch3.
Podobne si všimnite, že ak zostane v Cho's Molecule3Chch3 Atómy H na jednej strane a skupiny CH3 V inom by sa získal ústavný izomér: ChY2= C (ch3)2, 2-metylpropén (tiež známy ako izo-butén).
Môže vám slúžiť: dusičnan draselný (KNO3)Tieto štyri zlúčeniny majú rovnaký vzorec C4H8 Ale rôzne štruktúry. 1-butén a 2-metylpropén sú ústavné izoméry; a cis a trans-2-butén, geometrické izoméry medzi nimi dva (a ústavné vzhľadom na ostatné).
Stabilita
Spaľovacie teplo
Z horného obrázka, ktorý zo štyroch izomérov predstavuje najstabilnejšiu štruktúru? Odpoveď nájdete napríklad v spaľovacích zahrievania každej z nich.
Pri reagovaní s kyslíkom je izomér so vzorcom C4H8 sa transformuje na co2 uvoľnenie vody a teplo:
C4H8g) + 6o2(g) => 4Co2g) + 4h2O (g)
Spaľovanie je exotermické, takže čím viac tepla sa uvoľní, tým viac nestabilný je uhľovodík. Preto je najstabilnejší.
Spaľovacie zahrievanie pre štyri izoméry sú:
-1-butén: 2717 kJ/mol
-Cis-2-butén: 2710 kJ/mol
-Trans-2-butén: 2707 kJ/mol
-2-metylpropeno: 2700 kJ/mol
Všimnite si, že 2-metylpropén je izomér, ktorý vydáva menej tepla. Zatiaľ čo 1-butén je ten, ktorý uvoľňuje najviac tepla, čo sa premieta do väčšej nestability.
Stérický a elektronický účinok
Tento rozdiel v stabilite medzi izomérmi sa môže odpočítať priamo z chemickej štruktúry.
Podľa Alkénov, ten, ktorý má najviac substituentov R získava väčšiu stabilizáciu svojej dvojitého väzby. 1-butén je teda najstabilnejší, pretože má sotva substituent (-ch2Chvály3); to znamená, že je to monosustuido (rhc = cho2).
CIS a trans izoméry 2-buténu sa líšia v energii v dôsledku napätia van der steny, ktoré vznikajú stérickým efektom.
V izoméri cis3 Na tej istej strane dvojitého zväzku, ktoré sa navzájom odrazujú, zatiaľ čo v trans izoméri sú tieto od seba dostatočne vzdialené.
Ale prečo je potom 2-metylpropén najstabilnejším izomérom? Pretože elektronický efekt zasahuje.
V tomto prípade, hoci je to rozpustený alkén, dve skupiny CH3 Sú v rovnakom uhlíku; v geminálnej pozícii týkajúca sa druhej.
Tieto skupiny stabilizujú uhlík s dvojitou väzbou, ktorá mu dáva časť svojho elektronického oblaku (pretože je relatívne kyslejší tým, že má hybridizáciu SP2).
Okrem toho v 2-buténe majú jeho dva izoméry iba 2. uhlíky; Zatiaľ čo 2-metylpropén obsahuje 3. uhlík, väčšej elektronickej stability.
Môže vám slúžiť: Štruktúra materiálov: Koncept a príkladyMedzimolekulárne sily
Stabilita štyroch izomérov sa riadi logickým poriadkom, ale to isté sa nestane s intermolekulárnymi silami. Ak sa porovnávajú ich body topenia a varu, zistia, že nedodržiavajú rovnaký poriadok.
Očakávalo by sa, že trans-2-butén bude predstavovať najväčšie intermolekulárne sily na väčší povrchový kontakt medzi dvoma molekulami, na rozdiel od cis-2-buténu, ktorého kostra nakreslí C. Cis-2-butén však varí pri vyššej teplote (3.7. c), že trans izomér (0.96 ° C).
Podobné body varu pre 1-butén a 2-metylpropén by ich očakávali, pretože sú štrukturálne veľmi podobné. V tuhom stave sa však rozdiel mení radikálne. 1 -butén sa topí na -185.3 ° C, zatiaľ čo 2 -metylpropén pri -140.4. c.
Okrem toho sa izomér cis-2-buténu topí na -138.9 ° C, pri teplote veľmi blízko 2-metylpropénu, čo môže znamenať, že v pevnej látke majú rovnako stabilné usporiadanie.
Z týchto údajov je možné vyvodiť záver, že napriek tomu, že poznajú najstabilnejšie štruktúry, nevznikajú dostatok svetla v znalosti toho, ako intermolekulárne sily fungujú v kvapaline; A ešte viac, v tuhej fáze týchto izomérov.
Butenus používa
-Buténania, vzhľadom na svoje spaľovanie, sa dajú jednoducho použiť ako zdroj tepla alebo paliva. Preto by sa očakávalo, že plameň 1-buténu horúci viac ako plameň ostatných izomérov.
-Môžu sa používať ako organické rozpúšťadlá.
-Slúžia ako prísady, aby zvýšili hladinu oktánu benzínu.
-V rámci organickej syntézy sa 1-butén podieľa na produkcii iných zlúčenín, ako je: butylénxid, 2-glutanol, sukinimida a terbutilmecaptano (používaný na dodanie kuchynského plynu jej charakteristickú vôňu).
Tiež z buténových izomérov môžete získať butadieno (Cho2= Ch-chr = ch-chrk2), z ktorých je syntetizovaný umelý guma.
Okrem tejto syntézy bude rozmanitosť produktov závisieť od toho, ktoré molekuly sa pridávajú k dvojitej väzbe.
Napríklad alkylové halogenidy sa môžu syntetizovať, ak sú reagované s halogénmi; alkoholy, ak pridávajú vodu do kyslého média; a tretie krutosti, ak pridávajú alkoholy s nízkou molekulovou hmotnosťou (napríklad metanol).
Odkazy
- Francis a. Korytnačka. Organická chémia. Karboxylové kyseliny (šieste vydanie, strana 863-866). MC Graw Hill.
- Wikipedia (2018). Buteno. Prevzaté: Je to.Wikipedia.orgán
- YPF (júl). Butín. [PDF]. Prevzaté z: ypf.com
- William Reusch (2013). Reakcie sčítania alksov. Získané z: 2.Chémia.MSU.Edu
- Pubchem (2018). 1-butén. Získané z: pubchem.Ncbi.NLM.NIH.Vláda

