Komponenty hypotonického roztoku, príprava, príklady
- 1389
- 122
- Blažej Hrmo
A Hypotonický roztok Je to tá, ktorá predstavuje koncentráciu menšej rozpustenej látky vzhľadom na roztok oddelený alebo izolovaný semipermosabilnou chybou. Táto bariéra umožňuje rozpúšťadlu transte, vodu v prípade biologických systémov, ale nie všetky častice rozpustených látok.
Telesné tekutiny intracelulárnych a extracelulárnych stavovcov majú osmolaritu okolo 300 mosm/l. Aj keď sa predpokladá, že hypotonická tekutina má osmolaritu menšiu ako 280 mosm/l. Riešenie tejto osmolarity je teda hypotonické vo vzťahu k bunkové médium.
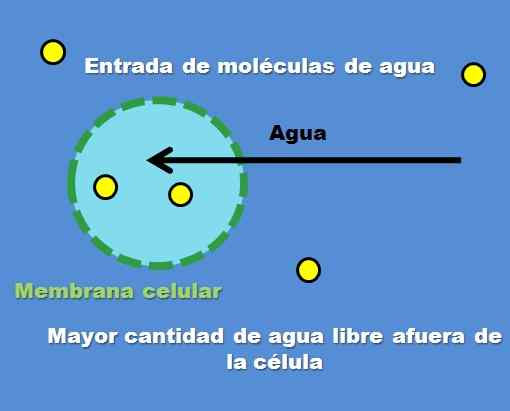
 Interakcia bunky s hypotonickým roztokom. Zdroj: Gabriel Bolívar.
Interakcia bunky s hypotonickým roztokom. Zdroj: Gabriel Bolívar. Príkladom hypotonického roztoku je 0,45% chlorid sodný. Ako sa však bunka alebo priehradka správa pred týmto typom riešenia? Vynikajúci obrázok odpovedá na túto otázku.
Koncentrácia častíc rozpustených látok (žlté body) je vyššia vo vonkajšej bunke. Ak má okolo bunky menej rozpustenej látky, existuje viac voľných molekúl vody, takže je reprezentovaná s intenzívnejšou modrou farbou v porovnaní s interiérom bunky.
Voda preteká smerom von cez osmózu na koncentrácie úrovní. V dôsledku.
[TOC]
Komponenty hypotonických riešení
Hypotonické roztoky pozostávajú z rozpúšťadla, ktoré, pokiaľ nie je uvedené inak, pozostáva z vody a rozpustených rozpustených v ňom, ako sú soli, cukry atď., v čistej alebo zmiešanej forme. Ale toto riešenie nebude mať žiadnu tonicitu, ak neexistuje semipermerbilná bariéra, ktorá sa stáva bunkovou membránou.
Môže vám slúžiť: dusičnan vápenatý (CA (NO3) 2)Musí existovať málo rozpustených solí, aby bola jej koncentrácia malá, zatiaľ čo „koncentrácia“ vody je vysoká. Mať viac voľnej vody mimo bunky, to znamená, že nerieši ani hydratačné častice rozpustenej látky, čím väčší tlak na bunkovú membránu a ďalšie bude mať tendenciu prechádzať ju k riedeniu intracelulárnej tekutiny.
Príprava hypotonického roztoku
Na prípravu týchto roztokov sa dodržiava rovnaký protokol ako sledovanie iných riešení. Vykazujú sa príslušné výpočty hmotnosti rozpustených látok. Potom sa odvážia, rozpustia sa vo vode a berú vlajku zdieľanú s objemom, ktorý jej zodpovedá.
Hypotonický roztok má nízku osmolaritu, zvyčajne menej ako 280 mosm/l. Takže pri príprave hypotonického riešenia musíme vypočítať vašu osmolaritu takým spôsobom, že jej hodnota je menšia ako 280 mosm/l. Osmolarita je možné vypočítať pomocou nasledujúcej rovnice:
Osmolarita = m · v · g
Kde m Je to molarita rozpustenej látky a vložka Počet častíc, v ktorých je zlúčenina disociovaná v roztoku. Neelektrolytické látky sa nerozlišujú, takže hodnota V sa rovná 1. Toto je prípad glukózy a iných cukrov.
Zatiaľ čo g je osmotický koeficient. Toto je korekčný faktor pre interakciu elektricky nabitých častíc (iónov) v roztoku. Pre zriedené roztoky a nepoddaných látok, napríklad a opäť glukóza, sa berie hodnota G rovnajúca sa 1. Potom sa hovorí, že molarita je identická s jej osmolaritou.
Príklad 1
Pripravte roztok chloridu sodného (NaCl) pri 0,5 % (P/V) Kontrola, či ide o hypotonický roztok alebo nie. Molekulová hmotnosť NaCl = 58,5 g/mol.
Prenáša sa 0,5 % roztok Gram NaCl na liter:
Môže vám slúžiť: peroxid vápenatý (CAO2): vlastnosti, riziká a použitiaNaCl v g/l = (0,5 g ÷ 100 ml) · 1.000 ml
= 5 g/l
A pokračujeme v výpočte jeho molárity a potom určíme jeho osmolaritu:
Molarita = hmotnosť (g/l) ÷ molekulová hmotnosť (G/mol)
= 5 g/l ÷ 58,5 g/mol
= 0,085 mólov/l
NaCl sa disociuje v dvoch častiach: NA+ (katión) a cl- (anión). Takže hodnota V = 2. Tiež, pretože ide o zriedený 0,5 %roztok NaCl, možno predpokladať, že hodnota G (osmotický koeficient) je 1. Máme potom:
Osmolarita (NaCl) = molarita · v · g
= 0,085 m · 2 · 1
= 0,170 osm/l o 170 mosm/l
Toto je hypotonické riešenie, pretože jeho osmolarita je oveľa nižšia ako referenčná osmolarita pre telesné tekutiny, ktorým je osmolarita v plazme, ktorej hodnota je okolo 300 MOSM/L L L L L L L L L L.
Príklad 2
Pripravte roztok zmesi chloridu vápenatého (CACL2) pri 0,055 % (p/v) a glukóze (c6H12Ani6) pri 4 % (p/v). Molekulové hmotnosti: CACL2 = 111 g/mol a c6H12Ani6 = 180 g/mol.
Vypočítame molaritu, ktorá má koncentrácie príslušných rozpustených látok pri 0,55 g/l a 40 g/l:
Molarita (CACL2) = 0,55 g/l ÷ 111 g/mol
= 4,95 · 10-3 M
= 4,95 mm
Molarita (c6H12Ani6) = 40 g/l ÷ 180 g/mol
= 0,222 m
= 222 mm
A rovnako vypočítame osmolarity, pretože vieme, že kliknutie2 Oddeľuje sa na troch iónoch, dva CL- A CA2+, a za predpokladu, že ide o veľmi zriedené riešenia, takže hodnota vložka Je to 1. Máme:
Osmolarita (CACL2) = 4,95 mm · 3 · 1
= 14,85 MOSM/L
Osmolarita (c6H12Ani6) = 222 mm · 1 · 1
= 222 MOSM/L
Nakoniec sa celková osmolarita riešenia stáva súčtom jednotlivých osmolarity; to znamená, z tých, ktoré sú nacl a glukóza. To je preto:
Môže vám slúžiť: refraktérne materiályCelková osmolarita roztoku = CACL osmolarita2 + osmolarita c6H12Ani6
= 222 MOSM/L + 14,85 MOSM/L
= 236,85 MOSM/L
Roztok zmesi chloridu vápnika a glukózy je hypotonický, pretože jej osmolarita (236,85 MOSM/L) je oveľa menšia ako v plazmatickej osmolarite (300 MOSM/L), ktorá sa považuje za referenciu.
Príklady hypotonických riešení
Roztok chloridu sodného
0,45 % roztok chloridu sodného sa intravenózne podáva pacientom s diabetickou ketózou, u ktorých sa vyvinie dehydratácia v intersticiálnych a intracelulárnych kompartmentoch. Voda prúdi z plazmy do týchto priehradiek.
Roztok laktátu zvonenia
Ringer Lactate Riešenie č. 19 je ďalším príkladom hypotonického roztoku. Jeho zloženie je 0,6 g chloridu sodného, 0,03 g chloridu draselného, 0,02 g chloridu vápenatého, 0,31 g laktátu sodného a 100 ml destilovanej vody. Je to roztok používaný na rehydratáciu pacientov a je mierne hypotonický (274 MOSM/L).
Odkazy
- Od Lehr Spilva, do. A muktans a. (1999). Sprievodca farmaceutickými špecialitami vo Venezuele. Vydanie xxxvª. Globálne vydania.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2020). Tonicita. Zdroj: In.Wikipedia.orgán
- Union Media LLC. (2020). Izotonické, hypotonické a hypertonické riešenia. Zdroj: UnionTestPrep.com
- Lodish H, Berk A, Zipursky SL, a kol. (2000). Oddiel 15.8Osmóza, vodné kanály a regulácia objemu buniek. Knižnica NCBI. Získané z: NCBI.NLM.NIH.Vláda
- John Brennan. (13. marca 2018). Ako vypočítať izotonicitu. Obnovené z: vedeckých.com
- « Matilde Hidalgo de Prince Biografia, príspevky a diela
- 15 najdôležitejších charakteristík divadla »

